Kháng thể
Một trong những thông báo thực nghiệm đầu tiên về đáp ứng miễn dịch thu được là sự trình bày về miễn dịch dịch thể chống lại độc tố vi khuẩn. Vào những năm đầu của thập kỷ 1900, bệnh nhân bị nhiễm trùng bạch hầu có thể bị nguy hiểm tính mạng nhưng có thể điều trị được bằng cách tiêm huyết thanh của những ngựa được gây miễn dịch với độc tố bạch hầu. Thể dạng miễn dịch này được gọi là miễn dịch dịch thể và được trung gian bởi một họ glycoprotein có tên là kháng thể. Kháng thể, phân tử MHC (phức hệ hoà hợp mô chủ yếu), và thụ thể kháng nguyên của tế bào T là ba loại phân tử tham gia vào việc nhận diện kháng nguyên trong miễn dịch thu được. Trong ba loại phân tử này thì kháng thể liên kết với nhiều cấu trúc kháng nguyên nhất, có khả năng tốt nhất trong việc phân biệt các kháng nguyên khác nhau, và liên kết với kháng nguyên với lực mạnh nhất. Kháng thể cũng là phân tử được nghiên cứu nhiều nhất trong ba phân tử liên kết kháng nguyên này.
Phân bố tự nhiên và sản xuất kháng thể
Kháng thể được phân bố trong các dịch sinh học ở khắp cơ thể và được tìm thấy trên bề mặt một số tế bào. Lymphô bào B là tế bào duy nhất sinh tổng hợp được phân tử kháng thể. Trong tế bào B, kháng thể hiện diện trong các bộ phận liên kết với mang trong bào tương (như hệ lưới nội bào và hệ Golgi) và trên bề mặt tế bào nơi mà chúng được xem như là một protein màng. Dạng tiết của kháng thể hiện diện trong huyết tương, dịch niêm mạc, và dịch gian bào của các mô. Kháng thể do tế bào B tổng hợp và sản xuất sẽ gắn lên bề mặt của một số tế bào hiệu quả miễn dịch như thực bào đơn nhân, tế bào NK (giết tự nhiên), và dưỡng bào là những tế bào có thụ thể đặc hiệu dành cho phân tử kháng thể.
Khi máu hay huyết tương tạo thành cục đông, kháng thể nằm trong khối dịch còn lại gọi là huyết thanh. Huyết thanh có chứa kháng thể chống lại một kháng nguyên nhất định nào đó được gọi là kháng huyết thanh. (Do đó, những nghiên cứu về kháng thể và tương tác của nó với kháng nguyên được gọi một cách kinh điển là huyết thanh học). Nồng độ của kháng thể trong huyết thanh chống lại một kháng nguyên đặc biệt nào đó thường được đo bằng cách tính xem đến độ pha loãng nào thì phản ứng giữa kháng nguyên và kháng thể không còn thấy được nữa. Độ pha loãng đó được gọi là hiệu giá kháng thể.
Một người lớn khoẻ mạnh nặng 70 kg sản xuất khoảng 3g kháng thể mỗi ngày. Khoảng 2/3 trong số này là kháng thể có tên là IgA được sản xuất bởi tế bào B trong thành ruột và đường hô hấp và sau đó chuyển vào lớp dịch niêm mạc của những nơi này. Một lượng lớn IgA đã được sản xuất chứng tỏ các cơ quan này có bề mặt niêm mạc rất lớn. Sau khi tiếp xúc với một kháng nguyên nào đó, đáp ứng tạo kháng thể ban đầu đa số xảy ra ở các mô lymphô, chủ yếu là lách, hạch bạch huyết và mô lymphô niêm mạc; nhưng những tế bào tạo ra kháng thể lâu dài thì có thể nằm ở các mô khác, nhất là ở tủy xương. Những kháng thể đã đi vào tuần hoàn thì có thời gian nửa đời sống rất ngắn. Loại kháng thể có nhiều nhất trong huyết thanh là IgG chỉ có thời gian nửa đời sống là 3 tuần.
Cấu trúc phân tử của kháng thể
Các nghiên cứu trước đây về kháng thể chủ yếu là lấy kháng thể từ máu các cá thể được gây miễn dịch rồi sau đó tinh chế để khảo sát. Nhưng cách này thì không thể dùng để xác định cấu trúc của kháng thể một cách chính xác, bởi vì huyết thanh chứa quá nhiều loại kháng thể được sản xuất bởi nhiều clôn tế bào B đáp ứng với nhiều quyết định kháng nguyên (epitốp) khác nhau (và được gọi là kháng thể đa clôn). Có hai phát hiện đột phá đã tạo điều kiện để có thể kháo sát cấu trúc kháng thể một cách chính xác. Phát hiện thứ nhất là bệnh nhân đa u tủy có một khối u tương bào tiết ra kháng thể đơn clôn với lượng đủ lớn trong máu và nước tiểu để có thể xác định tính chất hóa sinh của chúng. Phát hiện thứ hai, quan trọng hơn, là kỹ thuật tạo ra kháng thể đơn clôn được Georges Kohler và Cesar Milstein mô tả năm 1975. Họ đã tìm được cách làm cho tế bào sản xuất kháng thể bất tử bằng kỹ thuật tạo “u lai” (hybridoma); những u lai này cho phép sản xuất kháng thể chống lại chỉ một tính đặc hiệu kháng nguyên đã định trước. Việc tạo ra được quần thể tế bào sản xuất kháng thể thuần nhất này đã giúp cho các nhà nghiên cứu xác định được trình tự acid amin của từng phân tử kháng thể.
Đặc điểm chung của cấu trúc kháng thể
Các glycoprotein huyết tương hoặc huyết thanh trước đây thường được phân chia theo tính chất hòa tan của chúng thành albumin và globulin và phân chia sâu hơn dựa theo tính điện di của chúng. Hầu hết kháng thể được tìm thấy trong thành phần điện di nhanh thứ ba của globulin và được gọi là gamma globulin (gamma là chữ cái thứ ba trong mẫu tự Hy Lạp). Một tên thường gọi nữa của kháng thể là immunoglobulin (globulin miễn dịch), viết tắt là Ig. Trong quyển sách này hai thuật ngữ immunoglobulin và kháng thể thường được dùng với cùng một ý nghĩa.
Tất cả mọi phân tử kháng thể đều có chung một cấu trúc cơ bản giống nhau, và sự khác biệt chỉ thấy ở vị trí kết hợp kháng nguyên. Sự khác biệt của vùng kết hợp kháng nguyên giúp cho kháng thể liên kết dễ dàng với kháng nguyên về mặt cấu trúc. Trong mỗi cá thể có khoảng từ 107 đến 109 phân tử kháng thể khác nhau mang những vùng kết hợp kháng nguyên khác nhau. Các chức năng hiệu quả và tính chất hóa lý của kháng thể thường do phần không liên quan đến kháng nguyên đảm trách và những phần này thường không khác nhau mấy giữa các kháng thể.
Mỗi phân tử kháng thể có một cấu trúc lõi đối xứng được cấu tạo bởi hai chuỗi nặng và hai chuỗi nhẹ giống hệt nhau (Hình 3.1). Mỗi chuỗi nhẹ có trọng lượng phân tử khoảng 24 kD, và mỗi chuỗi nặng khoảng 55-70 kD. Một chuỗi nhẹ liên kết đồng hóa trị với một chuỗi nặng bằng một cầu disulphua và các chuỗi nặng cũng nối với nhau bằng những cầu disulphua. Cả chuỗi nhẹ và nặng đều chứa những chuỗi đơn vị đồng nhất và lặp đi lặp lại. Mỗi đơn vị có độ dài 110 acid amin cuộn lại một cách độc lập thành những búi gọi là lĩnh vực Ig (Ig domain). Một lĩnh vực Ig chứa hai tấm gấp β, mỗi lớp có 3-5 chuỗi polypeptid. Có nhiều protein quan trọng khác trong hệ thống miễn dịch cũng chứa những lĩnh vực có cấu tạo mô-típ tấm gấp tương tự như vậy và có các chuỗi acid amin giống như Ig. Tất cả những phân tử chứa cấu tạo theo mô-típ này được đặt chung một tên là siêu họ Ig (Ig superfamily), và tất cả những gen mã hóa cho các lĩnh vực Ig của những phân tử này được cho là đều tiến hóa từ một gen tổ tiên.
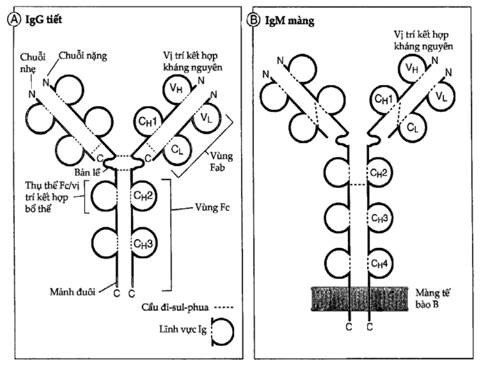
Hình 3.1. Cấu trúc của một phân tử kháng thể
A.Sơ đồ cấu trúc của một phân tử IgG. Diện kết hợp kháng nguyên được tạo bởi lĩnh vực thay đổi của chuỗi nhẹ (VL) và chuỗi nặng (VH) nằm cạnh nhau. Các vùng C của chuỗi nặng tận cùng tại phần đuôi.
B.Sơ đồ cấu trúc của phân tử IgM gắn trên màng tế bào lymphô B. IgM có nhiều hơn IgG một lĩnh vực vùng C chuỗi nặng (CH) và tận cùng bằng một đoạn C cắm xuyên qua màng tế bào.
C.Cấu trúc của IgG người được vẽ nhờ phép chụp tinh thể bằng tia X. Trong sơ đồ này chuỗi nặng được vẽ bằng màu xanh nước biển và đỏ, còn chuỗi nhẹ có màu lục.
Cả chuỗi nặng và nhẹ đều mang một đầu tận cùng amin luôn thay đổi (gọi là vùng biến đổi hay vùng V) tham gia vào việc nhận diện kháng nguyên và một đầu tận cùng cacboxyl hằng định (gọi là vùng hằng định hay vùng C); vùng hằng định của chuỗi nặng làm trung gian cho các chức năng hiệu quả. Trên chuỗi nặng, vùng V chỉ có 1 lĩnh vực Ig, nhưng vùng C thì có 3-4 lĩnh vực Ig. Mỗi chuỗi nhẹ chỉ cấu tạo bởi 1 lĩnh vực Ig vùng V và 1 lĩnh vực Ig vùng C. Vùng biến đổi của mỗi phân tử kháng thể giúp phân biệt kháng thể được sản xuất bởi một clôn tế bào B này với kháng thể được sản xuất bởi một clôn tế bào B khác. Vùng biến đổi của chuỗi nặng (được gọi là VH) nằm sát bên cạnh vùng V của chuỗi nhẹ ( được gọi là VL) để tạo nên diện kết hợp kháng nguyên (Hình 3.1) . Bởi vì đơn vị cấu tạo cơ bản của mỗi phân tử kháng thể chứa 2 chuỗi nặng và 2 chuỗi nhẹ nên nó có 2 diện kết hợp kháng nguyên. Các lĩnh vực của vùng C tách biệt với diện kết hợp kháng nguyên và không tham gia vào quá trình nhận diện kháng nguyên. Các vùng C của chuỗi nặng có khả năng tương tác với các phân tử và tế bào hiệu quả khác của hệ miễn dịch nên do đó đảm trách hầu hết các chức năng sinh học của kháng thể. Ngoài ra, đầu tận cùng cacboxyl của các chuỗi nặng có tác dụng gắn các phân tử kháng thể màng vào màng tế bào B. Vùng C của chuỗi nhẹ không tham gia vào các chức năng hiệu quả và cũng không dính vào màng tế bào.
Đặc điểm cấu trúc của vùng biến đổi và mối liên quan với sự liên kết kháng nguyên
Mỗi một kháng thể thường mang 3 đoạn ngắn acid amin ở vùng V (của cả chuỗi nặng và chuỗi nhẹ) rất riêng cho kháng thể đó và được gọi là vùng siêu biến. Những vùng siêu biến này có độ dài khoảng 10 acid amin và được giữ yên tại vị trí của nó chu ỗi peptid tạo nên lĩnh vực của vùng V. Trong mỗi phân tử kháng thể, 3 vùng siêu biến của vùng VL và 3 vùng siêu biến của vùng VH được kéo lại với nhau để tạo nên một cấu trúc không gian ba chiều, đó là diện kết hợp kháng nguyên. Bởi vì cấu tạo này được tạo ra sao cho khớp với cấu trúc không gian ba chiều của phân tử kháng nguyên tương ứng nên những vùng siêu biến này còn được gọi là vùng xác định tính bổ khuyết (complementarity -determined regions, CDR). Trên mỗi chuỗi acid amin của VL hoặc VH, các vùng này được đặt tên là CDR1, CDR2 và CDR3. Vùng CDR3 của cả VL và HL là vùng có độ biến đổi cao nhất trong số 3 vùng vừa kể. Có những cơ chế di truyền tạo ra tính đa dạng cao hơn ở CDR3 so với CDR1 và CDR2. Nghiên cứu hình ảnh tinh thể của kháng thể cho thấy các CDR tạo ra những cung hóa học đưa ra bề ngoài kháng thể để sẵn sàng tương tác với kháng nguyên. Sự khác biệt về trình tự acid amin trong các CDR của các phân tử kháng thể khác nhau tạo ra cấu trúc hóa học riêng biệt cho chúng và được thể hiện ra bề mặt của kháng thể để tạo nên tính đặc hiệu đối với kháng nguyên.
Đặc điểm cấu trúc của vùng hằng định và mối liên quan với chức năng hiệu quả
Các phân tử kháng thể có thể được chia thành nhiều lớp khác nhau dựa trên sự khác biệt về cấu trúc vùng C của chuỗi nặng. Các lớp kháng thể còn được gọi là isotyp và gồm có 5 lớp được đặt tên là: IgA, IgD, IgE, IgG, và IgM. Ở người, các isotyp IgA và IgG có thể được chia thành các tiểu lớp và đặt tên là: IgA1, IgA2, IgG1, IgG2, IgG3, IgG4. (ở chuột nhắt, loài động vật thường được dùng trong nghiên cứu miễn dịch học, thì lớp IgG được chia thành các tiểu lớp IgG1, IgG2a, IgG2b, và IgG3.) Vùng C của chuỗi nặng của tất cả các phân tử kháng thể trong một lớp hoặc tiểu lớp đều có chung một trình tự acid amin. Trình tự này khác với trình tự của lớp khác hay tiểu lớp khác. Các chuỗi nặng được đặt tên theo chữ cái Hy Lạp tương ứng với isotyp kháng thể: IgA1 chứa chuỗi nặng α1; IgA2 chứa α2; IgD chứa δ; IgE chứa ε; IgG1 chứa γ1; IgG2 chứa γ2; IgG3 chứa γ3; IgG4 chứa γ4 và IgM chứa μ. Trong kháng thể của IgM và IgE người, vùng C chứa 4 lĩnh vực Ig nối tiếp nhau. Vùng C của IgG, IgA, và IgD chỉ chứa 3 lĩnh vực Ig. Những lĩnh vực này được ký hiệu là CH và được đánh số từ đầu tận cùng amin đến đầu tận cùng cacboxyl (ví dụ CH1, CH2, .v.v.). Trong mỗi isotyp, các vùng này được ký hiệu cụ thể hơn (ví dụ Cγ1, Cγ2 trong IgG). Kháng thể có thể có tác dụng như một kháng nguyên khi nó được đưa vào một cơ thể lạ và kích thích cơ thể đó tạo kháng – kháng thể. Bằng cách gây miễn dịch một con vật bằng kháng thể lấy từ một con vật khác loài, chúng ta có thể sản xuất ra các kháng – kháng thể đặc hiệu cho một lớp hoặc tiểu lớp Ig, và kháng thể kiểu này thường được dùng thường xuyên trong các nghiên cứu lâm sàng hoặc thực nghiệm về đáp ứng miễn dịch dịch thể.
Những lớp và tiểu lớp kháng thể khác nhau sẽ tạo nên những chức năng hiệu quả khác nhau. Nguyên nhân là vì hầu hết các chức năng hiệu quả đều qua trung gian của sự kết hợp vùng C chuỗi nặng vào thụ thể của nó lên các loại tế bào như đại thực bào, tế bào NK, tế bào mast, hoặc kết hợp với các loại protein huyết tương khác nhau như protein bổ thể. Các lớp và tiểu lớp kháng thể khác nhau ở vùng C nên cũng khác nhau về chức năng hiệu quả.
Chuỗi nhẹ của kháng thể có hai lớp và được gọi là κ và λ phân biệt nhờ vùng hằng định tận cùng bằng cacboxyl. Mộ t phân tử kháng thể có thể có hoặc là 2 chuỗi nhẹ κ hoặc là 2 chuỗi nhẹ λ, và không bao giờ có mỗi loại một chuỗi. Trình tự acid amin của vùng C chuỗ i nhẹ κ (Cκ) khác với trình tự đó của vùng C chuỗi nhẹ λ (Cλ), nhưng trình tự Cκ của tất cả các phân tử kháng thể đều giống hệt nhau, và trình tự Cλ cũng vậy. Mặc dù có khác nhau về trình tự acid amin nhưng Cκ và Cλ hoàn toàn đồng nhất về mặt cấu trúc, và đều gập vào trong cùng một lĩnh vực Ig. Ở người, khoảng 60% phân tử kháng thể có chuỗi nhẹ κ và 40% có chuỗi λ. Người ta tìm thấy tỉ lệ này thay đổi rất rõ trên bệnh nhân u tế bào B đơn clôn bởi vì các clôn tế bào ung thư đã sản xuất những phân tử kháng thể v ới cùng một lớp chuỗi nhẹ mà thôi. Và người ta đã dùng tỉ lệ tế bào mang κ và tế bào mang λ để chẩn đoán u lymphô tế bào B. Ở chuột, lượng kháng thể chứa κ nhiều gấp 10 lần lượng kháng thể chứa λ. Khác với lớp chuỗi nặng, các lớp chuỗi nhẹ không tạo ra điều gì khác nhau về chức năng của kháng thể.
Kháng thể có thể xuất hiện dưới dạng chất tiết (dạng tiết) hoặc nằm trên màng tế bào (dạng màng). Dạng kháng thể này khác với kháng thể huyết thanh về trình tự acid amin ở đầu tận cùng cacboxyl của vùng C chuỗi nặng. Dạng tiết gặp ở trong máu và các dịch ngoại bào. Đối với d ạng này, trình tự acid amin của vùng CH được tận cùng bằng các acid amin ưa nước và tích điện. Đây là cấu trúc đặc trưng cho các protein gắn trên màng tế bào.
Các kháng thể IgG và IgE được tiết ra dưới dạng đơn phân tử tức ở dạng đơn vị kháng thể cơ bản (bao gồm 2 chuỗi nặng và 2 chuỗi nhẹ). Ngược lại, các kháng thể IgM và IgA thì thường tạo nên những phức hợp đa phân tử tức bao gồm từ 4 chuỗi nặng và 4 chuỗi nhẹ trở lên. Các kháng thể đa phân tử IgM và IgA còn chứa một polypeptid phụ với trọng lượng phân tử 15 kD gọi là chuỗi J (liên kết), gắn với các phân tử kháng thể bởi các cầu nối disulphua và có chức năng làm bền vững các phức hợp đa phân tử này.
Sự tổng hợp và biểu hiện của phân tử Ig
Các chuỗi nặng và nhẹ của Ig được tổng hợp trong các ribosom nằm trên bề mặt của hệ lưới nội bào. Sự kết hợp đồng hóa trị của các chuỗi nặng và các chuỗi nhẹ được thực hiện nhờ các cầu nối disulphua và cũng xảy ra trong hệ lưới nội bào. Sau khi được hình thành phân tử Ig được chuyển đến thể Golgi từ đó chuyển ra màng tế bào trong các nang nhỏ và sau đó được tiết ra khỏi tế bào qua mộ t quá trình gọi là thoát bào (exocytosis). Các protein khác cần gắn vào Ig như các chuỗi J cũng đồng thời được thực hiện trước khi bài tiết ra kh ỏi tế bào. Trong những tế bào sản xuất kháng thể lớp IgA và IgM thì sự sao chép của gen chuỗi nặng và gen chuỗi nhẹ được thực hiện đồng thời với sự sao chép gen chuỗi J.
Sự trưởng thành của các tế bào B trong tủy xương thường đi kèm với sự thay đổi biểu hiện gen Ig để dẫn đến sản xuất các phân tử Ig dưới các dạng khác nhau (Hình 3.2). Các tế bào sớm nhất của dòng lymphô B được gọi là tế bào tiền B sản xuất ra các dạng màng của chuỗi nặng μ, nhưng đa số các protein ở lại trong bào tương. Hầu hết các chuỗi nặng μ nội bào trong tế bào tiền B đều tự phân hủy ngay trong tế bào. Chỉ một lượng nhỏ các phân tử này được biểu hiện ở màng tế bào và kết hợp với những protein có tên là chuỗi nhẹ thay thế để tạo nên thụ thể của tế bào tiền B. Các tế bào B trưởng thành hoặc chưa trưởng thành đều sản xuất các chuỗi nhẹ κ hoặc λ để liên kết với chuỗi nặng μ tạo nên phân tử IgM. Sự tổ hợp này bảo vệ cho chuỗi nặng khỏi bị phân hủy trong nội bào và cho phép IgM biểu hiện trên bề mặt tế bào. Tế bào B trưởng thành có biểu hiện của IgM và IgD trên bề mặt. Các thụ thể Ig màng này có chức năng nhận diện kháng nguyên và khởi động quá trình hoạt hóa tế bào B. Thụ thể kháng nguyên của tế bào B liên kết không đồng hóa trị với hai protein màng khác là Igα và Igβ để tạo nên các phức hợp phân tử và điều này rất cần đối với việc thể hiện IgM và IgD bề mặt.
Khi tế bào B được kháng nguyên hoặc các kích thích khác hoạt hóa, chúng biệt hóa thành các tế bào sản xuất kháng thể. Quá trình này thường phối hợp với sự biến đổi các thể dạng sản xuất Ig. Một trong những biến đổi đó là sự chuyển từ Ig màng sang Ig tiết. Một biến đổi thứ hai là xuất hiện các biểu hiện khác của isotyp chuỗi nặng ngoài IgM và IgD. Quá trình này gọi là chuyển mạch isotyp chuỗi nặng.
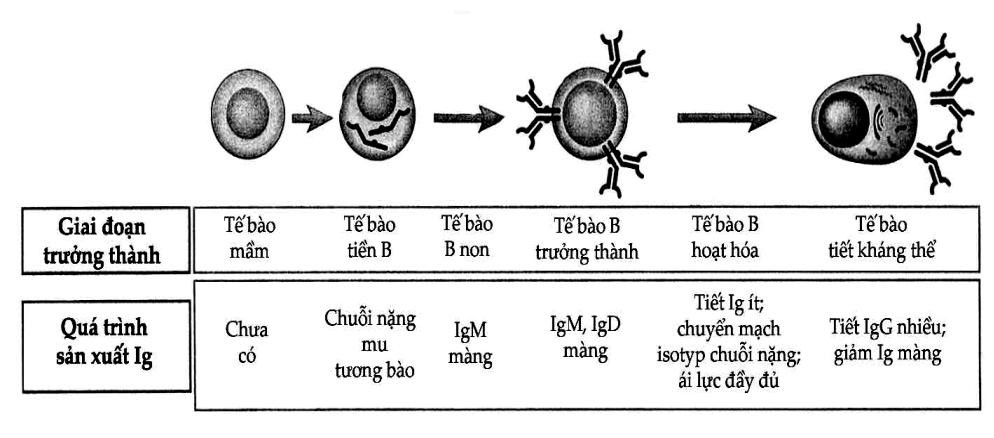
Hình 3.2. Sự bộc lộ Ig trong quá trình trưởng thành tế bào B
Các giai đoạn trưởng thành tế bào B thường đi kèm với các biến đổi trong sản xuất chuỗi nặng và chuỗi nhẹ của Ig.
Sự kết hợp kháng nguyên – kháng thể
Các đặc điểm liên quan đến quá trình nhận diện kháng nguyên
Phân tử kháng thể có nhiều đặc điểm cấu trúc rất quan trọng đối với quá trình nhận diện kháng nguyên cũng như thực hiện chức năng hiệu quả. Các đặc điểm này nằm chủ yếu ở vùng V của phân tử kháng thể.
Tính đặc hiệu (specificity)
Kháng thể bao giờ cũng kết hợp rất đặc hiệu cho kháng nguyên tương ứng của mình. Chỉ cần một khác biệt nhỏ về cấu trúc hóa học là có thể làm cho sự kết hợp kháng nguyên-kháng thể bị trở ngại. Tính đặc hiệu tinh tế của phân tử kháng thể hiện diện trên tất cả các lớp phân tử. Ví dụ, kháng thể có thể phân biệt hai quyết định kháng nguyên khác nhau chỉ ở một vị trí acid amin được thể hiện rất ít trên cấu trúc cấp hai. Bởi vì cấu tạo sinh hóa của tất cả sinh vật sống đều cơ bản là tương tự nhau, nên tính đặc hiệu cao này rất cần để kháng thể tạo được đáp ứng với một kháng nguyên của một vi khuẩn mà không tạo đáp ứng với phân tử có cấu trúc tương tự của cơ thể mình hay của vi khuẩn khác. Tuy vậy, cũng có trường hợp một số kháng thể được sản xuất để chống lại một kháng nguyên lại có thể liên kết với một kháng nguyên khác có cấu trúc liên quan. Điều này được gọi là phản ứng chéo. Kháng thể được tạo ra để chống vi khuẩn đôi khi lại cho phản ứng chéo với tự kháng nguyên của cơ thể mình và có thể gây ra một số bệnh lý miễn dịch.
Tính đa dạng (diversity)
Như đã trình bày ở phần trước, một cá thể có khả năng tạo ra một số lượng lớn (đến 109) kháng thể có tính đặc hiệu khác nhau. Sự hiện diện của lượng lớn kháng thể với tính đặc hiệu khác nhau này được gọi là tính đa dạng của kháng thể và toàn bộ sưu tập kháng thể với tính đặc hiệu khác nhau này được gọi là “hồ chứa” (repertoire) kháng thể. Cơ chế di truyền của tính đa dạng này nằm ở tế bào lymphô. Chúng được thực hiện trên cơ sở sự tái tổ hợp ngẫu nhiên của một số bộ trình tự DNA di truyền vào các gen chức năng mã hóa cho vùng V của chuỗi nặng và chuỗi nhẹ. Một cơ sở khác của tính đa dạng là sự thêm ngẫu nhiên các trình tự nucleotide không theo khuôn mẫu vào các gen đoạn V. Hàng triệu dạng cấu trúc khác nhau tập trung chủ yếu vào vùng siêu biến của cả chuỗi nặng và chuỗi nhẹ để tạo nên tính đặc hiệu đối với kháng nguyên.
Ái lực (affinitive) và ái tính (avidity)
Khả năng trung hòa độc tố và vi sinh vật của kháng thể luôn phụ thuộc vào sự gắn kết chặt chẽ của chúng vào kháng thể. Sự gắn kết này có được là do ái lực và ái tính cao của sự tương tác. Cơ chế tạo ra ái lực cao của kháng thể là do những biến đổi tinh vi tại vùng V của phân tử kháng thể trong giai đoạn đáp ứng dịch thể. Những biến đổi này được tạo ra do quá trình đột biến thân của tế bào lymphô B sau khi được kháng nguyên kích thích. Kết quả là hình thành những cấu trúc mới của lĩnh vực V, trong số đó có những cấu trúc gắn kết có ái lực cao hơn nhiều so với cấu trúc ban đầu của các lĩnh vực V (Hình 3.3). Những tế bào B sản xuất kháng thể có ái lực cao rất dễ được kháng nguyên kích thích và trở nên tế bào B chủ đạo đối với những lần tiếp xúc kháng nguyên về sau. Quá trình này được gọi là “sự trưởng thành về ái lực” có khả năng làm tăng dần ái lực trung bình của kháng thể đối với kháng nguyên trong việc tạo ra đáp ứng dịch thể. Ví dụ, nếu một kháng thể trong đáp ứng miễn dịch tiên phát đối với một kháng nguyên có hệ số ái lực liên kết Kd là 10-7 đến 10-9 M thì trong đáp ứng thứ phát đối với kháng nguyên đó ái lực sẽ gia tăng và hệ số Kd bây giờ sẽ là 11-11 M hay thậm chí nhỏ hơn.
Các đặc điểm liên quan đến chức năng hiệu quả
Các chức năng hiệu quả của kháng thể thường liên quan đến đoạn Fc của phân tử kháng thể, do đó những isotyp khác nhau ở đoạn Fc sẽ tạo ra chức năng hiệu quả khác nhau. Ví dụ, phân tử IgG thường gắn với tế bào vi khuẩn để chuyển vi khuẩn đến cho tế bào trung tính hoặc đại thực bào tiêu diệt. Điều này thực hiện được là nhờ phân tử IgG có gắn kháng nguyên nhờ có đoạn Fc mà có thể liên kết với chuỗi nặng γ của mình với phân tử thụ thể đặc hiệu cho đoạn Fc nằm trên bề mặt của tế bào trung tính và đại thực bào. Ngược lại, phân tử IgE gắn vào cơ thể giun tròn để chuyển chúng đến cho tế bào ái toan tiêu diệt vì trên tế bào này có nhiều thụ thể đặc hiệu dành cho IgE. Một cơ chế hiệu quả khác phụ thuộc Fc trong miễn dịch dịch thể là sự hoạt hóa hệ thống bổ thể theo con đường cổ điển. Hệ thống bổ thể tạo ra các hóa chất trung gian của phản ứng viêm và thúc đẩy quá trình thực bào cũng như ly giải tế bào đích. Quá trình này được bắt đầu với sự liên kết của một protein bổ thể có tên là C1q vào đo ạn Fc của phân tử kháng thể IgG hoặc IgM trong phức hợp kháng nguyên – kháng thể. FcR và vị trí kết hợp bổ thể của kháng thể đều nằm ở khu vực C của chuỗi nặng của tất cả các isotyp.
Tất cả các hiệu quả chức năng của kháng thể đều chỉ được thực hiện khi kháng thể đã liên kết với kháng nguyên chứ không phải ở dạng Ig tự do. Nguyên nhân là cần phải có ít nhất 2 đoạn Fc nằm kế cận nhau để có thể tác động vào các hệ thống hiệu quả như các protein bổ thể và FcR của việc thực bào. Yêu cầu phải có những phân tử liền kề này đảm bảo cho chức năng hiệu quả được thực hiện một cách đặc hiệu đến đúng kháng nguyên đích và loại bỏ chúng và cũng là nhằm làm cho các kháng thể lưu động tự do trong máu không tác động thừa vào hệ thống hiệu quả.
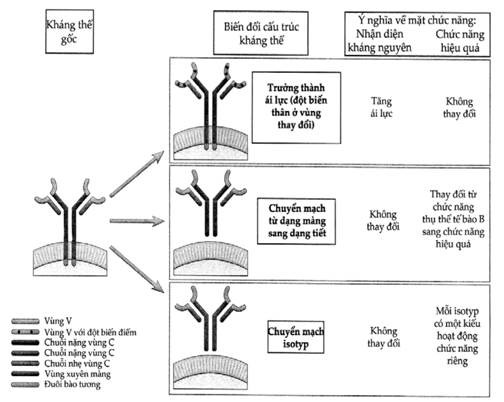
Hình 3.3. Các thay đổi của cấu trúc kháng thể trong quá trình đáp ứng miễn dịch dịch thể
Trong quá trình trưởng thành ái lực, đột biến có thể xảy ra ở vùng V dẫn đến thay đổi tính đặc hiệu trong khi chức năng hiệu quả phụ thuộc vùng C không thay đổi gì. Tế bào B hoạt hóa có thể chuyển các phân tử Ig màng sang Ig tiết. Ig tiết có thể có đột biến gen hoặc không. Trong quá trình chuyển mạch isotyp, có biến đổi ở vùng C trong khi vùng V không có gì thay đổi. Việc chuyển mạch isotyp có thể gặp ở cả Ig màng lẫn Ig tiết.
Sự thay đổi của isotyp kháng thể trong quá trình đáp ứng dịch thể sẽ ảnh hưởng việc đáp ứng miễn dịch hoạt động loại bỏ kháng nguyên nơi nào và ở đâu. Sau khi được kháng nguyên kích thích, một clôn tế bào B sẽ sản xuất kháng thể với các isotyp khác nhau nhưng có cùng lĩnh vực V tức lai đặc hiệu cùng 1 kháng nguyên. Các tế bào B chưa tiếp xúc kháng nguyên sẽ đồng thời sản xuất IgM và IgD có tác dụng như là thụ thể bề mặt đối với kháng nguyên. Khi tế bào B tiếp xúc với một vi khuẩn chẳng hạn thì trong tế bào sẽ xảy ra một quá trình gọi là “chuyển mạch isotyp” (isotype switching) trong đó typ của vùng CH do tế bào B sản xuất bị chuyển đổi nhưng còn vùng V và tính đặc hiệu thì không thay đổi (Hình 3.3). Vì quá trình chuyển mạch isotyp mà các tế bào tiền thân của tế bào B sản xuất IgD và IgM sản xuất được các isotyp khác có khả năng tiêu diệt kháng nguyên tốt hơn. Ví dụ, kháng thể chống vi khuẩn và virus chủ yếu là typ IgG là typ có xu hướng thúc đẩy quá trình thực bào vi khuẩn, còn typ chuyên đối phó với giun tròn thì chủ yếu là IgE là typ có khả năng phá hủy ký sinh trùng này.
Vùng C trên chuỗi nặng của kháng thể cũng quyết định vị trí phân bố của phân tử kháng thể ở các mô. IgA thường là isotyp duy nhất có thể được bài tiết qua lớp thượng bì của niêm mạc và do đó IgA là lớp kháng thể chủ yếu của các dịch tiết kể cả sữa. Trẻ sơ sinh được bảo vệ khỏi các bệnh nhiễm trùng nhờ kháng thể IgG được truyền từ mẹ sang trong quá trình mang thai và trong giai đoạn sớm của thời kỳ bú mẹ. Sự truyền này được thực hiện qua trung gian của một thụ thể Fc đặc biệt có trong bánh nhau (giúp kháng thể đi vào tuần hoàn phôi) và trong đường tiêu hóa của trẻ sơ sinh (giúp hấp thụ kháng thể từ sữa mẹ).
Kháng thể
- Tác giả: Đại học Y Hà Nội
- Chuyên ngành: Miễn dịch – Di truyền – Sinh học phân tử
- Nhà xuất bản:Đại học Y Hà Nội
- Năm xuất bản:2006
- Trạng thái:Chờ xét duyệt
- Quyền truy cập: Cộng đồng