Quá mẫn
Khi một đáp ứng miễn dịch xảy ra qúa mức hoặc sai quy cách thì sẽ gây tổn thương mô, trường hợp này ta gọi là quá mẫn. Qúa mẫn là một đặc điểm của cá thể và nó xảy ra khi có tiếp xúc với kháng nguyên lần thứ hai. Coombs và Gel đã chia quá mẫn ra làm bốn typ: typ I, typ II, tyb III, và tyb IV. Trong thực tế một phản ứng quá mẫn thường xảy ra trong sự phối hợp của các typ với nhau. Điểm lưu ý quan trọng nhất là những phản ứng miễn dịch này không còn mang tính chất có lợi cho cơ thể như các phần trước chúng ta đã đề cập mà chúng thường gây ra viêm cũng như các tổn thương khác. Ba typ quá mẫn dầu là các phản ứng qua trung gian kháng thể, con typ thứ tư thì chủ yếu là qua trung gian của tế bào T và đại thực bào.
Quá mẫn typ I
Quá mẫn typ I được đặc trưng bởi phản ứng dị ứng xảy ra tức thì ngay sau khi tiếp xúc với kháng nguyên (trong trường hợp này gọi là dị nguyên) từ lần thứ hai trở đi. Phản ứng quá mẫn này tùy thuộc vào s ự tấn công các tế bào mast đã được mẫn cảm với dị nguyên và được gắn với các lgE đặc hiệu dị nguyên, gây ra sự giải phóng các hóa chất trung gian của phản ứng viêm.
Hiện tượng phản vệ – Một biểu hiện đặc biệt của dị ứng
Nếu chúng ta tiêm một liều duy nhất 1 mg albumin lòng trắng trứng cho một con chuột lang, chúng ta sẽ không thấy điều gì xảy ra cả. Thế nhưng, nếu lặp lại liều tiêm 2 hay 3 tuần sau đó thì con vật đã mẫn cảm đó sẽ chịu một phản ứng rất nặng nề mà người ta gọi là phản vệ toàn thân. Con vật chết sau một vài phút. Khi khám nghiệm giải phẫu bệnh, ta thấy các phế quản và tiểu phế quản bị chít hẹp trầm trọng, đồng thời có hiện tượng co thắt hệ thống cơ trơn cũng nh ư giãn phế nang. Những phản ứng tương tự có thể gặp ở người, đặc biệt khi bị rắn cắn, ong đốt, hoặc tiêm penicilin cho một số cá thể nào đó. Trong nhiều trường hợp chỉ cần tiêm adrenalin tức thì theo đường tĩnh mạch để chống co cơ trơn là có thể cứu được mạng sống cho nạn nhân.
Huyết thanh lấy từ các con vật hoặc từ người có cơ địa dị ứng đã được mẫn cảm với dị nguyên có thể truyền thụ động cho con vật khác và gây được phản vệ thực nghiệm trên con vật này khi cho tiêm dị nguyên lần thứ hai. Điều này nói lên rằng ít nhất có một yếu tố thể dịch quan trọng đã tham gia vào việc gây phản ứng phản vệ. Sau này người ta đã chứng minh được yếu tố quan trọng đó là IgE.
IgE – Kháng thể quan trọng của dị ứng
Đáp ứng tạo kháng thể IgE là mộ t phản ứng tại chỗ nghĩa là nó xảy ra nơi dị nguyên thâm nhập vào cơ thể là da và niêm mạ c cũng như tại các hạc lympho lân cận. IgE được sản xuất bởi các t ế bào B được mẫn cảm dị nguyên và dưới sự giúp đỡ của tế bào T. Sự sản xuất IgE tại chỗ sẽ gây mẫn cảm tế bào mast tại vùng đó, đồng thời nó sẽ đến gắn lên tế bào mast, một phần khác IgE đi vào máu và gắn lên cả tế bào nằm ở các mô khác.
Lượng IgE huyết thanh thường tăng cao trong bệnh dị ứng và cả trong các bệnh nhiễm ký sinh trùng. Cần lưu ý rằng lượng IgE tăng cao sẽ giúp chẩn đoán bệnh dị ứng nhưng lượng IgE thấp không có nghĩa là loại træì được bệnh này. Sản xuất IgE khi có dị nguyên là một hoạt đông mang tính chất di truyền và được kiểm soát bởi những gen chuyên biệt.
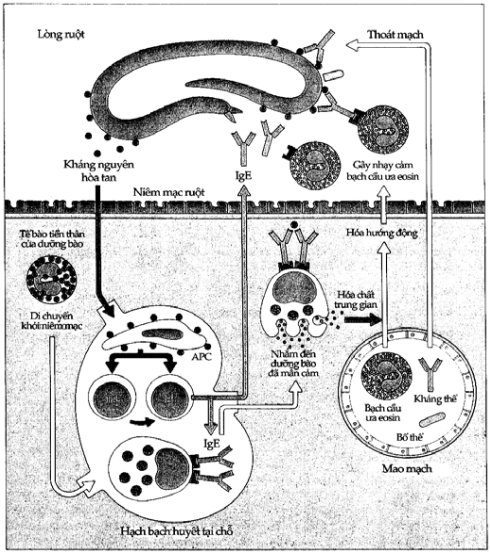
Hình 9.1. Vai trò có lợi của IgE trong nhiễm ký sinh trùng
Khi nhiễm giun sán kháng nguyên hóa tan của chúng đi qua niêm mạc vào cơ thể tạo ra sản xuất IgE. Tế bào mast cũng được huy động, hoạt hóa bởi IgE và sản xuất hóa chất trung gian tạo ra phản ứng viêm và tăng tính thấm niêm mạc ruột.
Với nhiều tác dụng bấ t lợi mà IgE đã tạo ra trên vành cơ thể có cơ địa dị ứng, người ta đã đặt câu hỏi là liệu IgE có tác dụng nào có lợi đối với cơ thể không? Câu trả lời là: có. Nếu IgE không ngăn chặn sự xâm nhập của vi sinh vật hay giun sán vào niêm mạc đường tiêu hóa thì vi sinh vật đến tiếp xúc với các tế bào mast đã được gắn IgE đưa đến giải phóng các chất trung gian có tác dụng hóa hướng động đối với các tế bào trung tính và tế bào ái toan cần thiết cho sự đề kháng tại chỗ. Ngoài ra, đã từ lâu người ta biết rằng vai trò của IgE đóng vai trò quan trọng trong sự đề kháng với giun sán mà cơ chế tác dụng được mô tái ở Hình 9.1
Một điều đáng lưu ý là bởi vì khoảng một phần ba dân số thế giới bị nhiễm ký sinh trùng nên chúng ta có thể nghĩ rằng trong quá trình tiến hóa động vật, IgE đã được hình thành nhằm chống ký sinh trùng, còn dị ứng có lẽ chỉ là hậu quả không may của bước tiến hóa này mà thôi.
Tế bào mast – Trung tâm của phản ứng
Từ lâu người ta nhận thấy rằng tế bào mast không giống nhau giữa các loại, chúng khác nhau về tính chất bắt màu thuốc nhuộm, về cấu trúc bên ngoài của các hạt và cả về cơ chế vỡ hạt. Tuy nhiên trong một cơ thể tế bào mast ở mô liên kết hoặc ở niêm mạc thường được dùng làm điển hình cho tế bào mast của toàn cơ thể (Hình 9.2).
Hình 9.2. Hình ảnh kính hiển vi điện tử của tế bào mast (của chuột)
Tế bào mast thường gặp xung quanh các mạch máu của hầu hết các mô. Mặc dù chúng t ương đối thuần nhất trong mỗi cơ thể, người ta cũ ng th ấy có sự khác biệt về kích thước và số lượng giữa tế bào mast ở phúc mạc và tế bào mast ở da. Ở người, vị trí có nhiều tế bào mast nhất là niêm mạc của đoạn giữa ruột và niêm mạ c ph ổi. Khi cơ thể bị nhiễm ký sinh trùng người ta cũng thấy tăng số lượng tế bào mast ở ruột.
Một đặc điểm quan trong của tế bào mast là trên bề mặt của chúng có nhiều thụ thể dành cho đoạn Fc của phân tử IgE, viết tắt là Fcε-R. Thụ thể này có vai trò quan trọng trong phản ứng dị ứng vì chúng sẽ truyền tín hiệu gây vỡ hạt nội bào khi có hiện tượng liên kết chéo xảy ra giữa các thụ thể này. Nhưng, chúng ta cần nhớ rằng, trong cơ thể, ngoài tế bào mast, một số tế bào khác cũng có mang thụ thể Fcε như tế bào kiềm, một số tế bào T và B, tế bào mono, đại thực bào, tế bào ái toan và tiểu cầu.
Liên kết chéo giữa các Fcε-R gây ra hoạt hóa tế bào mast
Một khi IgE gắn thụ thể Fcε trên tế bào mast và tế bào ái kiềm, sự mất hạt sẽ xảy ra khi có liên kết chéo giữa các phân tử IgE dẫn đến liên kết chéo các thụ thể Fcε. Các tình huống có thể tạo ra liên kết chéo được mô tả ở Hình 9.3.
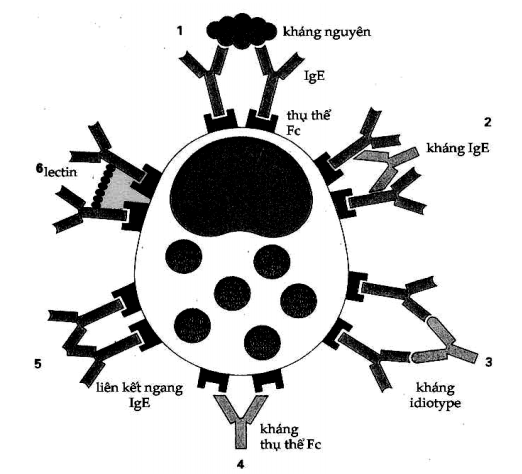
Hình 9.3. Hoạt hóa tế bào mast qua trung gian của thụ thể Fcε
Tế bào mast được hoạt hóa nếu hai thụ thể Fcεkế cận được nối với nhau. Điều này có thể xảy ra do vai trò kết nối của: (1) kháng nguyên, (2) kháng thể kháng IgE, (3) kháng thể idiotyp, (4) kháng thể chống thụ thể Fc, (5) liên kết chéo của bản thân IgE, và (6) các phân tử lectin.
Người ta đã tách được thụ thể Fcε của một dòng tế bào ái kiềm bị ung thư hóa để khảo sát cấu trúc của thụ thể này. Nó có một cấu trúc bốn chuỗi, hai alpha và hai beta. Sau khi tạo được những kháng thể kháng các thành phần này, người ta đã dùng chúng để liên kết chéo các thụ thể và gây được sự mất hạt mà không cần đến IgE. Các lectin trong đó có PHA và Con A cũng có thể liên kế t các IgE lại ở các vị trí các nhánh carbonhydrat và do đó có thể gây mất hạt mà không cần dị nguyên. Điều này giải thích các trường hợp một số cá thể bị mề đay do ăn dâu tây là loài quả chứa rất nhiều lectin.
Cũng như các cách cấu tạo cầu nối giữa các thụ thể Fcε trình bày ở hình 9.3, có nhiều hợp chất có khả năng mạnh trong việc làm mất hạt tế bào mast. Chất quan trọng nhất thường gặp trong cơ thể là các sản phẩm thoái hóa trong quá trình hoạt hóa bổ thể, mà cụ thể là C3a và C5a. Người ta thường gọi chúng là độc tố phản vệ (anaphylactoxin). Các độc tố phản vệ còn có tác dụng trên nhiều tế bào khác nhau như tế bào trung tính, tiểu cầu và đại thực bào. Ngoài ra, còn nhiều hóa chất có tác dụng trực tiếp lên tế bào mast để gây mất hạt như calcium inophore, ACTH tổng hợp, codein và mocphin tất cả các hợp chất này hoạt hóa tế bào mast bằng cách tạo dòng ion calci đi vào tế bào.
Dòng ion calci đi vào tế bào có hai tác dụng chính. Thứ nhất, làm cho các hạt di chuyển đến màng tế bào, hòa màng với màng tế bào và vỡ các hạt ra ngoài để giải phóng các chất trung gian đã được tổng hợp trong hạt. Thứ hai, tạo ra sự tổng hợp ngay các hóa chất trung gian mới từ acid arachidonic dẫn đến sự sản xuất các prostaglandin và leukotrien. Các hóa chất trung gian này có tác dụng lên các mô tại chỗ và lên phổi tạo ra triệu chứng co thắt phế quản, phù niêm mạc và tăng tiết đưa đến dị ứng.
Dị ứng atopy
Thuật ngữ atopy lần đầu tiên được Coca và Cooke (1923) sử dụng để mô tả bệnh cảnh lâm sàng của quá mẫn typ I bao gồm hen, chàm, sốt cỏ khô và mề đay ở những cá thể có người trong gia đình cũng hay mắc bệnh cảnh tương tự.
Người ta cho rằng mô hình sốc phản vệ ở động vật có liên quan đến bệnh hen và sốt cỏ khô ở người, nhưng trong khi mô hình phản vệ này cho thành công trong 90% lần thí nghiệm thì ở người khi cho tiếp xúc lần thứ hai với dị nguyên chỉ có 5- 10% là cho phản ứng quá mẫn. Do đó người ta cho rằng phản ứng quá mẫn typ I tức phản ứng dị ứng có liên quan chặt chẽ đến yếu tố di truyền mà đ iều này ít quan trọng ở động vật. Vì thế mà Coca và Cooke nghĩ rằng bệnh dị ứng ở người khác về cơ bản với phản ứng phản và ở động vật và họ gọi các bệnh dị ứng ở người là bệnh atopy. Hiện nay, thuật ngữ atopy được dùng như một thuật ngữ để chỉ một số bệnh có một số biểu hiện giống nhau như hen, chàm và viêm mũi dị ứng.
Những người đầu tiên mô tả cơ chế của phản ứng dị ứng tức quá mẫn typ I là Praunitz và Kustner (1921). Họ đã phát hiện trong huyết thanh bệnh nhân có một chất mà họ gọi là reagin, chất này có thể giúp để truyền thụ động phản ứng dị ứng sang cho cá thể khác qua đường da. Khoảng 45 năm sau, Ishizaka và cộng sự đã chứng minh chất reagin này là IgE.
Các thử nghiệm lâm sàng đối với dị ứng
Tính mẫn cảm thường được đánh giá dựa vào đáp ứng đối với kháng nguyên đưa vào nội bì. Sự sản xuất histamin và các hóa chất trung gian khác nhanh chóng tạo ra nốt phù nề và đỏ da, đạt tối đa trong vòng 30 phút và sau đó giảm dần. Vai trò của kháng thể IgE có thể chứng minh bằng phản ứng phản vệ thụ động da dùng huyết thanh người bệnh thử trên da người bình thường hoặc da khỉ. Đó là phản ứng Prausnitz-Kustner.
Càng ngày người ta càng thấy rõ rằng sau phản ứng phù và đỏ da tại chỗ là một phản ứng muộn khác có thể tồn tại đến 24 giờ; phản ứng này được đặc trưng bởi sự thâm nhiễm dày đặc của tế bào và phù nề nhiều hơn so với giai đoạn sớm. Người ta cho rằng hóa chất trung gian quan trọng trong phản ứng muộn là yếu tố hoá hướng động tế bào trung tính có trọng lượng phân tử cao. Chúng ta có thể thấy rõ biểu hiện của giai đoạn muộn này trong niêm mạc mũi, phế quản của những người bị dị ứng và đặc biệt là bệnh nhân hen.
Đối với việc định lượng IgE đặc hiệu, thử nghiệm hấp thụ dị ứng phóng xạ (Radioallergosorbent test, RAST) tỏ ra cũng tốt như phản ứng lẫy da (skin prick test) nhưng lại tiện lợi hơn vì không phải tiến hành trên bệnh nhân. Trong một số trường hợp, cho niêm mạc mũi thử thách với dị nguyên lại cho kết quả dương tính nhạy hơn hai phản ứng trên, điều này có lẽ là do khả năng tổng hợp tại chỗ của IgE.
Điều trị bệnh dị ứng
Nếu chúng ta theo dõi toàn bộ chuỗi phản ứng từ khi tiếp xúc với dị nguyên cho đến khi xuất hiện các biểu hiện atopy thì có thể thấy rằng có nhiều biện pháp nhằm ngăn chặn sự xuất hiện của bệnh này (Hình 9.4)
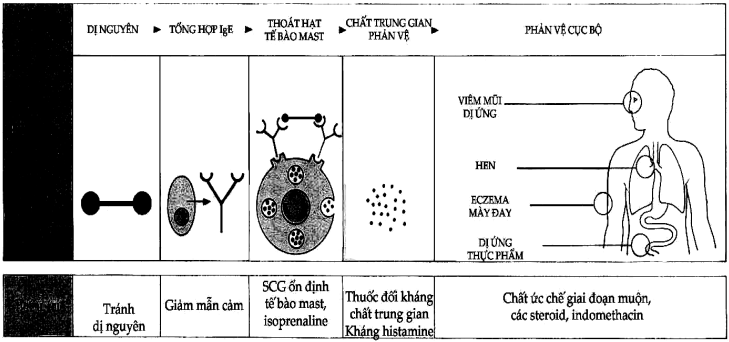
Hình 9.4. Điều trị bệnh dị ứng: các vị trí của phản vệ cục bộvà khả năng điều trị tương ứng
Một biện pháp cũng thường được dùng đó là giải mẫn cảm bằng cách tiêm vào cơ thể lặp lại nhiều lần những liều nhỏ dị nguyên. Người ta giải thích mục đ ích của phương pháp này là nhằm, tạo ra sự sản xuất kháng thể “phong bế” IgE có chức năng chuyển hướng dị nguyên để khỏi tiếp xúc với IgE đã gắn trên các mô cơ thể. Ngoài ra, nếu tương tác tế bào thật sự quan trọng trong việc tổng hợp IgE thì việc tiêm dị nguyên liều nhỏ nhiều lần sẽ có lợi ở chỗ tạo ra các tế bào dung nạp và cả T ức chế đồng thời qua đó để không tạo đặc hiệu dị ứng (mà bản chất là phản ứng miễn dịch) đối với dị nguyên khi có tiếp xúc về sau.
Đối với các thuốc chống dị ứng, các loại như isoprenaline, sodium cromoglycate có tác dụng khá tốt vì chúng gắn vào những thụ thể tế bào mast giúp tế bào này khỏi bị tác động. Các triệu chứng dị ứng không phải luôn luôn khống chế được bằng các loại kháng histamin, nhất là khi bệnh nhân đang chịu tác động bởi phản ứng giai đoạn muộn và lúc đó thì các loại cocticoid có thể giúp ích.
Tính di truyền của phản ứng dị ứng
Những nghiên cứu đầu tiên vào những năm 1920 cho thấy rằng những cặp vợ chồng bị dị ứng thì có tỉ lệ sinh con bị dị ứng cao hơn. Tỉ lệ đẻ con bị mắc bệnh dị ứng ở những cặp vợ chồng này là 50%. Có ba cơ chế di truyền chính điều hòa phản ứng dị ứng:
Lượng IgE toàn phần: Nghiên cứu những gia đình với ít nhất một thành viên có mức IgE cao trong máu đã xác minh giả thuyết cho rằng mức IgE cao có liên quan với một gen trội.
Sự phối hợp với HLA: Người ta thấy tính đáp ứng với một dị nguyên nào đó có liên quan đến một HLA nhất định. Ví dụ, đa số bệnh nhân dị ứng với dị nguyên Ra3 lấy từ cỏ phấn hương (ragweed) có mang HLA-A2, với dị nguyên Ra5 của cỏ này là HLA-A3, B7.
Cơ địa tăng đáp ứng miễn dịch: Có những người có cơ địa tăng đáp ứng với khá nhiều loại kháng nguyên. Đây là cơ sở để phản ứng dị ứng dễ dàng xảy ra. Những người có cơ địa này về mặt di truyền được thấy là đa số mang HLA-B8, HLA-Dw3. Trong đó HLA-B8 rất thường gặp trong những dạng tăng tính phản ứng khác như trong các bệnh tự miễn chẳng hạn. Do đó, người ta cho rằng ở những bệnh nhân có phản ứng dị ứng có lẽ có giảm chức năng tế bào Ts (đơn clôn hoặc đa clôn) di truyền tương tự như trong bệnh tự miễn.
Quá mẫn typ II
Trong thể dạng quá mẫn này, kháng thể chống kháng nguyên bề mặt tế bào đích hoặc kháng nguyên mô đích tác dụng lên các phân tử thành phần bổ thể đồng thời phối hợp với nhiều tế bào hiệu quả khác để gây thương tổn các tế bào đích và các mô xung quanh.
Cơ chế tổn thương
Hệ thống bổ thể có hai chức năng. Khi tác dụng một mình nó có thể gây tiêu màng tế bào đã mẫn cảm với kháng thể. Sự hoạt hoá bổ thể xảy ra theo con đường cổ điển để tạo ra phức hợp tấn công màng C5b56789. Ngoài ra, sự liên kết của C3 hoạt hóa với tế bào đích và kháng nguyên đã opsonin hoá tế bào đích làm cho nó dễ gắn vào các tế bào hiệu quả có thụ thể C3 (Hình 9.5). Một số tiểu lớp kháng thể có thụ thể trên một số tế bào hiệu quả, nhờ thế nó tạo được sự opsonin hóa như trường hợp bổ thể để tế bào hiệu quả có thể tiêu diệt tế bào đích. Các loại tế bào khác nhau có một cơ cấu thụ thể khác nhau.
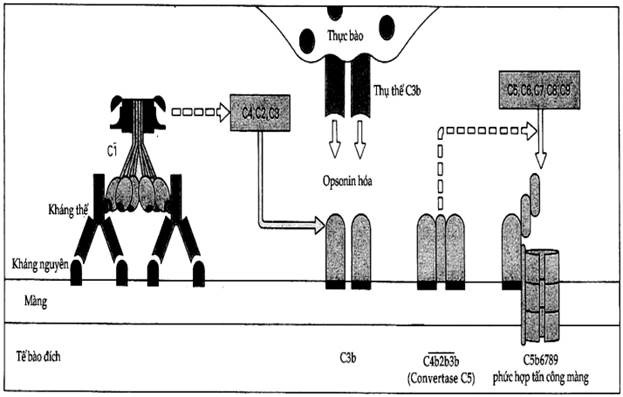
Hình 9.5. Hoạt hóa bổ thể trong phản ứng quá mẫn typ II
Kháng thể gắn với kháng nguyên trên tế bào đích và hoạt hóa bổ thể theo con đường cổ điển dẫn đến hình thành C4b2b3b. Sau đó enzym chuyển C5 có thể hoạt hóa con đường ly giải và gây tổn thương tế bào bằng phức hợp tấn công màng C5-9.
Các kích thích hóa hướng động thu hút các tế bào hiệu quả đến nơi nó phản ứng quá mẫn typ II giống như chúng bị thu hút đến ổ viêm bởi các vi khuẩn. Chất trung gian đặc biệt quan trọng là C5a, chất này có khả năng thu hút cả tế bào trung tính lẫn đại thực bào.
Cơ chế mà các thực bào gây tổn thương cho tế bào đ ích trong quá mẫn typ II giống hệt cơ chế mà hệ miễn dịch bình thường gây tổn thương cho vi sinh vật. Đa số các tác nhân gây bệnh b ị giết trong túi thực bào bởi các enzym, các ion, các chấ t oxy hóa, … Các tế bào thực bào không thể tiêu hóa các tế bào đ ích lớn, khi đó chúng buộc phải phóng thích các hạt tiêu thể ra chỗ đích đã mẫn cảm và các hạt này vỡ ra, giải phóng các enzym ra ngoài gây tổn thương mô (Hình 9.6). Người ta gọi đây là hiện tượ ng thực bào ngoài (exocytocis) . Trong một số phản ứng, như phản ứng ca tế bào trung tính với sán máng, hiệu qủa phản ứng là có lợi nhưng nếu mô của cơ thể chủ cũng bị mẫn cảm thì cũng bị kháng thể tác dụng theo cơ chế tương tự và gây tổn thương cho cơ thể chủ.
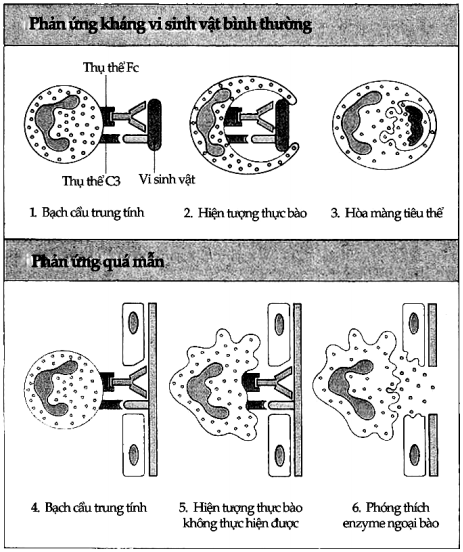
Hình 9.6. Cơ chế gây tổn thương
Phản ứng chống vi khuẩn bình thường: (1) Tế bào tiếp cận với vi khuẩn qua Fc và C3; (2)vikhuẩn bị thực bào; (3) và bị tiêu thể phá hủy trong túi thực bào. Trong quá mẫn týp II: tế bào chủ được gắn với kháng thể và thực bào theo kiểu tương tự, nhưng vì đích tấn công quá lớn, như trường hợp màng đáy (4) nên tế bào trung tính phải nỗ lực hết sức (5) và giải phóng các enzym bên trong tế bào ra ngoài để phá hủy đích (6).
Phản ứng typ II giữa các cá thể cùng loài
Phản ứng truyền máu
Hiện nay đã có ít nhất là 15 hệ thống nhóm máu được tìm thấy ở người, mỗi hệ thống bao gồm một bộ kháng nguyên có mặt trên hồng cầu được mã bởi một locus gen. Mộ t cá thể có một nhóm máu nào đó có thể nhận dạng hồng cầu mang những kháng nguyên của hệ nhóm máu khác và sản xuất kháng thể chống lại. Kháng thể này có thể được sản xuất tự nhiên, đó là trường hợp của hệ ABO. Người ta cho rằng cơ thể đã sản xuất được kháng thể tự nhiên này mà không cần gây mẫn cảm là nhờ nó nhận dạng được các quyết định kháng nguyên nhóm máu có mặt trên rất nhiều vi sinh vật. Tuy nhiên, trong đa số các trường hợp, thì cá thể chỉ sản xuất kháng thể chống các nhóm máu khác sau khi tiếp xúc với kháng nguyên.
Truyền máu cho một người đã có kháng thể chống kháng nguyên của hồng cầu chuyền vào sẽ dẫn đến phản ứng truyền máu. Độ trầm trọng của phản ứng phụ thuộc vào lớp và số lượng của kháng thể liên quan. Kháng thể chống kháng nguyên hệ ABO thường là IgM, chúng sẽ gây ngưng kết, hoạt hoá bổ thể, và tan máu trong lòng mạch. Các nhóm máu khác thường gây sản xuất kháng thể IgG, và mặc dù kháng thể này ít gây ngưng kết hơn IgM nhưng nó lại hoạt hoá cơ chế quá mẫn typ II làm vỡ hồng cầu. Vỡ hồng cầu có thể gây sốc, đồng thời các sản phẩm vỡ ra từ hồng cầu có thể gây hoại từ ống thận cấp. Phản ứng truyền máu do không cùng nhóm máu cũng có thể xảy ra sau nhiều ngày hoặc nhiều tuần trên người trước đây chưa hề có mẫn cảm và gây ra triệu chứng thiếu máu, vàng da.
Phản ứng truyền máu đối với các thành phần khác của máu như bạch cầu, tiểu cầu cũng có thể xảy ra nhưng hậu quả của nó không nặng nề như phản ứng đối với hồng cầu.
Bệnh huyết tán trẻ sơ sinh do không phù hợp Rhesus
Bệnh thường xảy ra trong trường hợp mẹ mang nhóm máu Rh- có bào thai Rh+. Sự mẫn cảm của mẹ đối với hồng cầu Rh+ của con đi ngược vào máu mẹ gây nên sản xuất kháng thể kháng hồng cầu Rh+ trong máu mẹ và rồi chuyển sang con qua nhau thai (Hình 9.7).
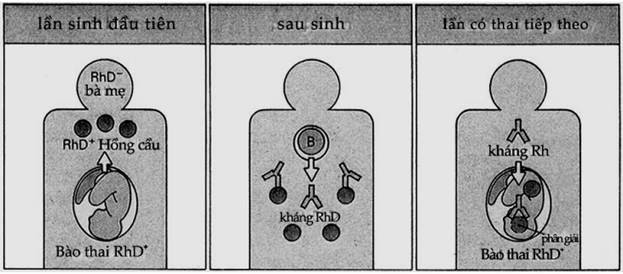
Hình 9.7. Bệnh huyết tán trẻ sơ sinh
Hồng cầu phôi có Rh+ vào tuần hoàn mẹ kích thích sản xuất kháng thể anti-Rh.
Kháng thể này theo máu vào bào thai thai và gây phá hủy hồng cầu bào thai.
Đối với đứa con đầu tiên, do kháng thể kháng hồng cầu Rh+ thường ít nên trẻ thường không bị ảnh hưởng gì nhiều. Nhưng những đứa con càng về sau thì càng có nguy cơ tan máu cao hơn.
Ngoài nhóm máu Rh ra, kháng nguyên K của hệ Kell cũng có thể gây bệnh huyết tán ở trẻ sơ sinh.
Ghép cơ quan
Một mảnh ghép cơ quan cùng loài, một khi tồn tại lâu dài nhờ chống lại được sự tấn công dữ dội ban đầu của miễn dịch qua trung gian tế bào, vẫn có thể kích thích cơ thể nhận tạo kháng thể chống lại các mặt trên bề mặt mảnh ghép. Các kháng thể này có khả năng gây độc trực tiếp hoặc giúp cho các thực bào cũng như tế bào K gắn vào tế bào đích và tạo những tấn công không đặc hiệu. Chúng có thể gây kết dính tiểu cầu khi gắn lên trên bề mặt của nội mô mạch máu. Và Phản ứng thải tối cấp thường xảy ra nếu trong cơ thể đã có sẵn các kháng thể này (do ghép lần trước).
Phản ứng quá mẫn typ II tự miễn
Có một số cá thể tự mình sản xuất kháng thể chống với hồng cầu bản thân mình, do đó gây ra bệnh thiếu máu huyết tán tự miễn. Chẩn đoán bệnh này dựa vào thử nghiệm Coombs d ương tính (Hình 9.8) . Thử nghiệm này giúp xác định kháng thể hiện di ện trên hồng cầu bệnh nhân. Thi ếu máu huyết tán tự miễn được chia làm ba loại tùy theo loại tự kháng thể có mặt trong máu bệnh nhân:
Tự kháng thể nóng, chỉ phản ứng với kháng nguyên ở nhiệt độ 37oC
Tự kháng thể lạnh, chỉ phản ứng ở nhiệt độ dưới 37oC
Kháng thể tạo ra do dị ứng thuốc.
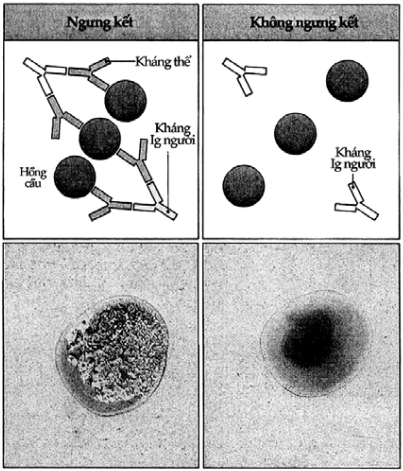
Hình 9.8. Phản ứng Coomb gián tiếp
Phản ứng này dùng để phát hiện kháng thể trên hồng cầu bệnh nhân. Nếu có kháng thể thì những hồng cầu này sẽ bị ngưng kết khi ta cho kháng thể anti-Ig người vào hỗn dịch.
Huyết thanh của bệnh nhân mắc bệnh viêm tuyến giáp Hashimoto cũng có chứa một số tự kháng thể mà trong phòng thí nghiệm, khi có sự hiện diện của bổ thể, chúng sẽ gây độc trực tiếp tế bào tuyến giáp được nuôi cấy. Trong hội chứng Goodpasture, tự kháng thể chống màng đáy cầu thận đã được chứng minh là có hiện diện. Kháng thể này cùng với các thành phần bổ thể gắn lên màng đáy để rồi phản ứng bổ thể sẽ dẫn đến sự tổn thương trầm trọng của màng. Nhiều tác giả cũng cho rằng phản ứng gây ra do kháng thể chống thụ thể acetylcholine trên các bản thần kinh vận động của tế bào cơ vân (Hình 9.9) gây bệnh nhược cơ nặng nên xếp vào phản ứng quá mẫn typ II.
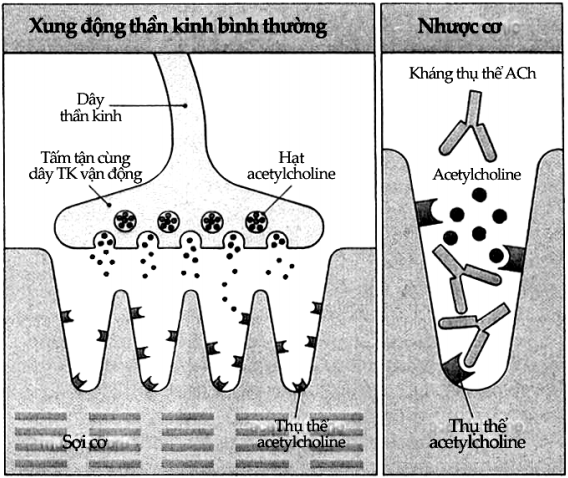
Hình 9.9. Bệnh nhược cơ nặng
Bình thường xung động thần kinh được truyền vào tế bào cơ vân qua một hóa chất trung gian là acetylcholin. Chất này gắn vào thụ thể của nó trên bản thân kinh vận động để gây tác dụng. Trong bệnh nhược cơ nặng, kháng thể chống thụ thể acetylcholin phong bế thụ thể làm cho acetylcholin bị giảm tác dụng. Đây là một trong những cơ chế gây bệnh.
Phản ứng do thuốc typ II
Điều này rất phức tạp. Thuốc có thể gắn vào các thành phần cơ thể qua đó các hapten trong thành phần thu ốc trở thành kháng nguyên thực sự và kích thích một số cá thể nào đó (mà chúng ta chưa biết là cá thể nào) tạo ra phản ứng miễn dịch chống lại. Nếu kháng thể IgE được sản xuất, phản ứng phản vệ có thể xảy ra. Trong một số trường hợp, nhất là đối với các thuốc mỡ bôi ngoài da, quá mẫn muộn qua trung gian tế bào có thể sẽ xuất hiện. Riêng ở đây chúng ta đang đề c ập đến quá mẫn typ II, thì chúng ta có thể ghi nhận rằng thuốc có thể gây ra các phản ứng dị ứng và phản ứng tự miễn chống các tế bào máu bao gồm hồng cầu và tiểu cầu. Thường thì phản ứng xảy ra nhằm chống lại thuốc hoặc các chất chuyển hóa của thuốc và phản ứng đòi hỏi sự hiện diện của cả thuốc lẫn kháng thể. Khi ngừng thuốc thì phản ứng giảm đi. Bệnh cảnh đầu tiên được gặp là xuất huyết giảm tiểu cầu do dùng Sedormid. Người ta đã thống kê được các thuốc gây thiếu máu giảm tiểu cầu bao gồm rất nhiều loại trong đó thường gặp nhất là penicillin, quinin và sulfonamid.
Quá mẫn typ III
Đây là typ quá mẫn xảy ra do sự tấn công của các phức hợp miễn dịch (PHMD) lên các tế bào và mô cơ thể.
Các thể bệnh phức hợp miễn dịch
PHMD được hình thành khi kháng thể liên kết với kháng nguyên, sau đó chúng sẽ bị loại bỏ nhờ các tế bào của hệ lưới nội mô. Tuy nhiên, cũng có sự hình thành phức hợp lại dẫn đến phản ứng quá mẫn. Các bệnh do PHMD có thể xếp làm ba nhóm:
Nhóm 1, đây là nhóm của các trường hợp nhiễm trùng tồn tại dai dẳng bao gồm nhiễm liên cầu tan máu, tụ cầu, plasmodium vivax, virus viêm gan. Kháng thể được sản xuất ở mức độ yếu dần đến hình thành PHMD mạn tính và lắng đọng vào các mô.
Nhóm 2, bệnh PHMD là biến chứng của bệnh tự miễn, trong đó sự sản xuất liên tục tự kháng thể đối với một tự kháng nguyên nào đó dẫn đến sự hình thành PHMD kéo dài và các tế bào của hệ lưới nội mô bị quá tải không loại trừ được. Cuối cùng là xuất hiện lắng đọng PHMD ở các mô.
Nhóm 3, trong nhóm này PHMD được hình thành ở bề mặt cơ thể như ở phổi chẳng hạn xảy ra sau khi thở hít lâu dài các chất liệu có tính kháng nguyên. Một ví dụ là bệnh phổi của nông dân và bệnh của người nuôi chim.
Các cơ chế viêm trong quá mẫn typ III
Phức hợp miễn dịch có khả năng khởi động nhiều quá trình viêm. Chúng có thể tương tác với hệ thống bổ thể dẫn đến hình thành C5a. C5a có tính chất hóa hướng động và cũng là các độc tố phản vệ. Chúng gây ra sự giải phóng các amin hoạt mạch từ tế bào mast và tế bào ái kiềm, do đó làm tăng tính thấm thành mạch và thu hút bạch cầu múi, PHMD cũng có thể tương tác với tiểu cầu qua thụ thể Fc, dẫn đến sự kết tập tiểu cầu và hình thành các vi huyết khối, để rồi làm tăng hơn nữa tính thấm thành mạch do giải phóng các amin hoạt mạch. (Hình 9.10).
Các bạch cầu múi được thu hút đến cố gắng để thực bào PHMD, nhưng nếu PHMD đã bị giữ trong các mô thì việc thực bào rất khó khăn, vì thế mà các thực bào phải giải phóng các enzym ra ngoài nhằm mục đích làm tiêu phức hợp nhưng cũng đồng thời làm tổn thương mô (Hình 9.10). Thật ra, nếu các enzym này được giải phóng ra trong máu thì lập tức nó bị trung hòa ngay bởi các chất ức chế nhưng tại các mô không có các chất ức chế này nên các enzym này gây tổn thương mô dễ dàng.
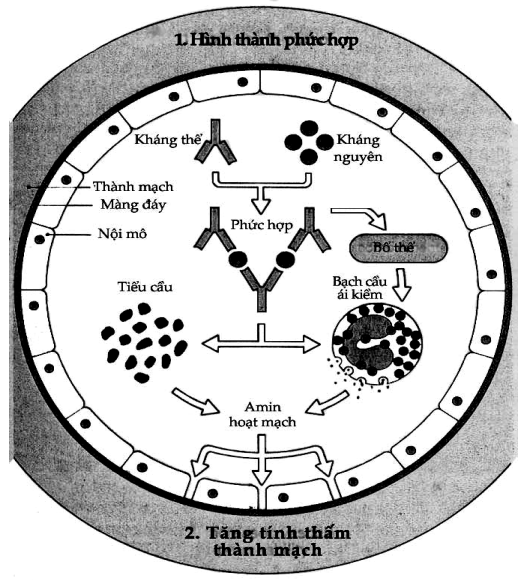
Hình 9.10. Sự lắng đọng của phức hợp miễn dịch trên thành mạch máu
Kháng thể và kháng nguyên tạo thành phức hợp. Phức hợp này hoạt hóa bổ thể đồng thời tác động gây giải phóng các amin hoạt mạch làm tăng tính thấm thành mạch. Phức hợp cũng tạo ra kết tập tiểu cầu tạo ra các vi huyết khối và thu hút tế bào trung tính đến gây thêm những tổn thương khác cho thành mạch.
Mô hình thực nghiệm của bệnh phức hợp miễn dịch
Đối với ba nhóm bệnh nói trên chúng ta có ba mô hình: bệnh huyết thanh đối v ới nhóm 1, bệnh tự miễn ở chuột NZB/NZW ở nhóm 2 và phản ứng Arthus ở nhóm 3.
Bệnh huyết thanh
Trong bệnh huyết thanh PHMD lưu động sẽ lắng đọng vào khi tính thẩm thấu thành mạch tăng, sau đó dẫn đến bệnh cảnh viêm như viêm thận, viêm khớp. Vào thời kỳ tiền kháng sinh bệnh huyết thanh là một biến chứng nguy hiểm do liệu pháp huyết thanh. Ngày nay, bệnh chủ yếu được nghiên cứu trên mô hình động vật. Con vật (thỏ) được tiêm một protein hòa tan (ví dụ albumin huyết thanh bò). Khoảng sau một tuần kháng thể hình thành đi vào tuần hoàn và tạo ra phức hợp với kháng thể trong trạng thái thừa kháng nguyên. Các phức hợp miễn dịch nhỏ này chỉ bị loại trừ bởi hệ thực bào đơn nhân một cách chậm chạp. V ới sự hiện diện của PHMD, lượng bổ thể toàn phần giảm nhiều và các triệu chứng của bệnh huyết thanh xuất hiện do lắng đọng các hạt phức hợp ở màng đáy cầu thận và trong các mạch máu nhỏ. Khi phức hợp bị loại bỏ hoàn toàn thì con vật hồi phục, nhưng bệnh có thể duy trì mạn tính nếu hàng ngày ta vẫn liên tục cho thêm kháng nguyên vào cơ thể con vật.
Bệnh PHMD
Dùng thế hệ F1 của dòng chuột lai NZB/NZW ta có được mô hình động vật của bệnh tự miễn giống như bệnh lupus ở người. Trong con vật có rất nhiều tự kháng thể như kháng hồng cầu, kháng nhân, kháng DNA và kháng Sm. Khi mới sinh ra con vật hoàn toàn bình thường nhưng sau 2-3 tháng thì có các triệu chứng thiếu máu huyết tán, thử nghiệm Coombs dương tính, có kháng thể kháng nhân, có tế bào LE, có PHMD nhiều trong tuần hoàn và lắng đọng cả ở thận cũng như ở mạch mạc trong não thất. Bệnh gặp chủ yếu ở con cái, và tử vong xảy ra khoảng vài tháng sau khi triệu chứng xuất hiện.
Phản ứng Arthus
Đây là một phản ứng xảy ra cục bộ trong và xung quanh những mạch máu nhỏ và thường thấy được ngoài da. Con vật được gây miễn dịch nhiều lần cho đến khi có đủ lượng kháng thể (chủ yếu là IgG). Khi tiêm kháng nguyên vào dưới da lập tức phản ứng xảy ra do hình thành phản ứng kháng nguyên – kháng thể và tạo ra PHMD ở xung quanh chỗ tiêm. Phản ứng có cường độ cao nhất sau 4-10 giờ. Tùy theo lượng kháng nguyên tiêm vào mà phù và xuất huyết có thể xảy ra ở chỗ tiêm. Sau đó phản ứng yếu dần và giảm hẳn sau 48 giờ. Các nghiên cứu bằng huỳnh quang cho thấy ban đầu kháng nguyên, kháng thể và bổ thể lắng đọng ở thành mạch, sau đó là thâm nhiễm tế bào trung tính và trong lòng mạch thì đầy tiểu cầu. Sự tập trung tiểu cầu này có thể đưa đến tắc mạch và hoại tử trong những trường hợp nặng. Sau 24-48, giờ bạch cầu múi được thay thế bằng tế bào đơn nhân và có khi cả tương bào. Sự hoạt hóa bổ thể luôn cần cho phản ứng Arthus xuất hiện. Tỷ lệ kháng thể/ kháng nguyên rất quan trọng cho phản ứng tối đa. Nhìn chung, PHMD được tạo ra khi thừa kháng nguyên hoặc thừa kháng thể thì ít độc hại hơn phức hợp được tạo ra khi số lượng của chúng tương đương nhau.
Tại sao phức hợp miễn dịch lắng đọng ở mô
Đối với sự lắng đọng PHMD có hai câu hỏi được đặt ra: tại sao phức hợp lắng đọng ở mô và tại sao trong mỗi bệnh nào đó thì PHMD lại có xu hướng lắng đọng ở một mô nhất định? Chúng ta lần lượt xem câu trả lời qua các yếu tố sau đây:
Tăng tính thấm thành mạch
Yếu tố quan trọng nhất đối với sự lắng đọng có lẽ là sự tăng tính thấm thành mạch. Bổ thể, tế bào mast, tế bào ái kiềm và tiểu cầu có thể xem là những nhân tố góp phần tích cực để giải phóng các amin hoạt mạch và làm tăng tính thấm thành mạch. Nếu ta dùng các chất kháng histamin để ức chế trước khi hiệu quả tăng tính thấm bị phong bế và sự lắng đọng cũng khó xảy ra.
Quá trình huyết động
Sự lắng đọng của PHMD cũng dễ xảy ra ở những nơi có áp lực máu cao cũng như có dòng chảy xoáy. Trong các mao mạch cầu thận áp lực máu cao gấp gần 4 lần so với các mao mạch nơi khác. Nếu áp lực được làm cho giảm bằng cách thắt bớt một phần động mạch thận thì sự lắng đọng giảm xuống. Còn ngược lại, nếu ta làm tăng huyết áp thực nghiệm cho con vật thì các triệu chứng của bệnh huyết thanh cấp xảy ra nhanh hơn. Ngoài ra, tại những nơi mà thành mạch có hình dáng tạo ra luồng xoáy cuộn như nơi động mạch chẻ đôi, nơi có hiện tượng lọc máu, .v.v. thì sự lắng đọng cũng được làm cho dễ hơn.
Sự liên kết với kháng nguyên ở mô
Những lý do kể trên không giải thích được tại sao trong những bệnh khác nhau thì PHMD có xu hướng lắng đọng vào những mô khác nhau. Lý do có thể là do kháng nguyên có mặt trong phức hợp là kháng nguyên đặc hiệu mô. Người ta đã chứng minh rằng DNA có ái lực rất mạnh với collagen của màng đáy cầu thận nên phức hợp DNA và anti-DNA trong bệnh thận lupus thường hay lắng đọng ở màng đáy cầu thận tạo ra bệnh thận lupus. Cũng có trường hợp cả kháng nguyên và kháng thể cùng được sản xuất tại cùng một nơi trong mô đích. Đó là trường hợp của bệnh viêm khớp dạng thấp.
Kích thước của PHMD
Vị trí chính xác của PHMD một phần phụ thuộc vào kích thước của phức hợp. ta thấy rỏ điều này ở thận. Phức hợp nào nhỏ thì có thể chui lọt qua màng đáy cầu thận vào nằm giữa màng đáy và tế bào có chân (podocyte), còn phức hợp nào lớn thì mắc lại nằm giữa các tế bào nội mô và màng đáy (Hình 9.11).
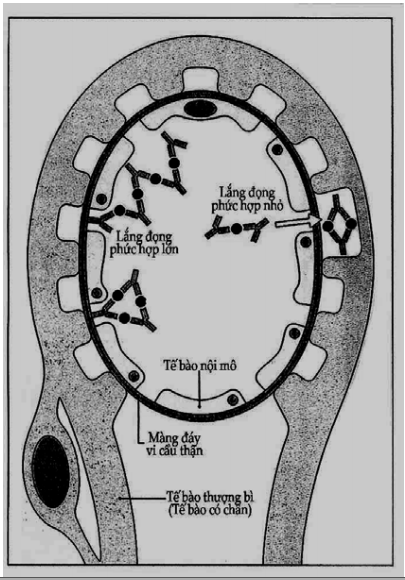
Hình 9.11. Vị trí lắng đọng của phức hợp ở thận phụ thuộc vào kích thước phức hợp trong tuần hoàn
Phức hợp lớn dễ lắng đọng ở màng đ áy cầu thận, còn phức hợp nhỏ thì đi xuyên qua màng đáy và tìm thấy ở phía tế bào biểu mô của cầu thận.
Lớp Immunoglobulin
Lớp Immunoglobulin có thể ảnh hưởng sự lắng đọng của PHMD. Ví dụ trong bệnh lupus, các lớp và tiểu lớp kháng thể anti-DNA có liên quan chặt chẽ đến tuổi và giới. Khi chuột NZB/NZW già có sự chuyển đổi lớp Ig từ chỗ lớp trội là IgM sang lớp trội là IgG2. Điều này xảy ra ở chuột cái sớm hơn ở chuột đực và đồng thời với sự xuất hiện của bệnh thận tức là trước khi chuột chết khoảng 2 -3 tháng. Điều này chứng tỏ rằng lớp và tiểu lớp của kháng thể cũng quan trọng trong quá trình lắng đọng của PHMD.
Quá mẫn typ IV – Quá mẫn muộn
Theo phân loại của Coombs và Gel, quá mẫn typ IV hay quá mẫn muộn được dùng để chỉ tất cả những phản ứng quá mẫn xảy ra sau 12 giờ tính từ khi kháng nguyên xâm nhập vào lần thứ 2. Lúc đó cơ chế của phản ứng vẫn chưa được biết, và cho đến nay cũng chỉ biết được có một phần. Có một điều đã rõ đó là có nhiều phản ứng miễn dịch có thể gây ra quá mẫn muộn. Không giống ba typ quá mẫn kia, quá mẫn muộn chỉ truyền thụ động được từ con vật này sang con vật khác bằng tế bào T chứ không phải bằng huyết thanh. Tế bào T cần thiết để tạo ra quá mẫn muộn được gọi là T quá mẫn muộn (tức Td).
Quá mẫn muộn thường gặp trong nhiều phản ứng dị ứng đối với vi khuẩn, virus và nấm, trong viêm da tiếp xúc do nhạy cảm với một s ố hóa chất có công thức cấu tạo đơn giản và trong phản ứng thải bỏ mảnh ghép. Mô hình được hiểu biết rỏ nhất là phản ứng Mantoux thực hiện bằng cách tiêm tuberculin cho một cơ thể đã có vi khuẩn mycobacterium đột nhập và cơ thể tạo phản ứng miễn dịch tế bào chống vi khuẩn này. Phản ứng Mantoux được đặc trưng bởi đỏ và cứng da xuất hiện nhiều giờ sau khi tiêm, đạt tối đa sau 24 đến 48 giờ, sau đó giảm dần. Trong giai đoạn sớm nhất của phản ứng, ta thấy có sự tập trung tế bào đơn nhân xung quanh các mạch máu và sau đó là sự thoát mạch của rất nhiều tế bào mono và bạch cầu múi. Trong giai đoạn tiếp theo ta có thể thấy sự thâm nhiễm kéo dài của tế bào lymphô và tế bào thuộc hệ đơn nhân/đại thực bào. Điều này ngược với phản ứng Arthus trong đó chỉ có thâm nhiễm bạch cầu múi.
Chúng ta cũng có thể thấy phản ứng da tương tự thế này đối với các protein hòa tan trong truờng hợp trước đó đã gây mẫn cảm bằng các protein này trộn với tá chất Freud hoàn toàn. Tuy nhiên, trong một số trường hợp, nếu con vật được mẫn cảm với chỉ kháng nguyên hoặc tá chất Freud không hoàn toàn (tức không có xác vi khuẩn lao) thì phản ứng quá mẫn muộn xảy ra trong thời gian ngắn hơn và phản ứng da cũng chỉ tồn tại thoáng qua. Người ta gọi phản ứng này là quá mẫn Jones-Mote, gần đây được đổi tên là “quá mẫn tế bào ái kiềm da” (cultaneous basophil hypersensitivity) vì có một tỉ lệ rất cao tế bào ái kiềm thâm nhiễm ở da.
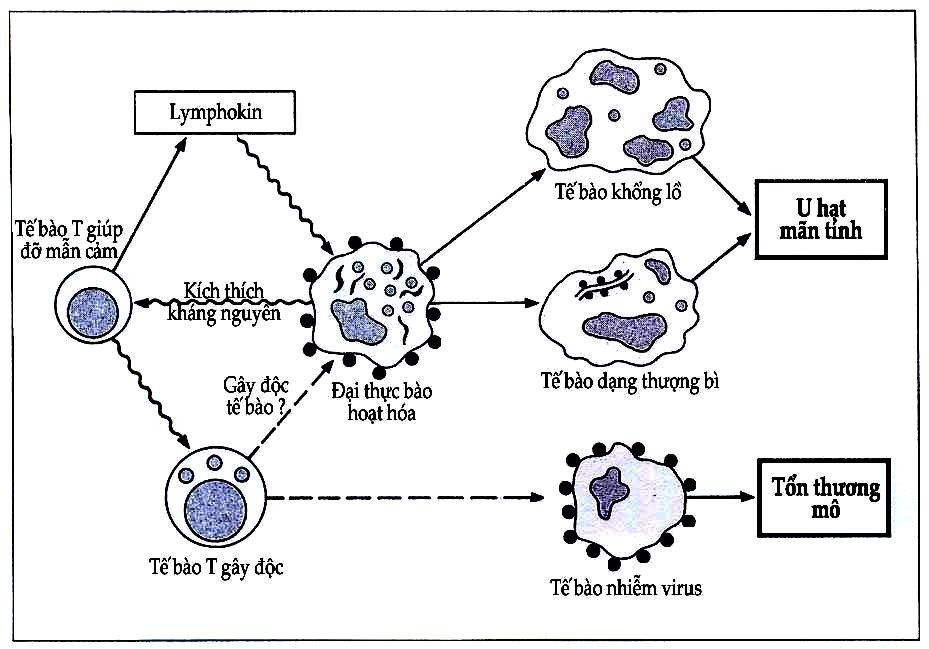
Hình 9.12. Cơ sở tế bào của quá mẫn typ IV
Tế bào Th tiết ra lymphokin tác dụng lên đại thực bào gây kết tập tế bào tại vị trí kháng nguyên. Hiện tượng thực bào mạn tính sau đó tạo nên hình ảnh u hạt. Đồng thời tế bào Tc cũng được hoạt hóa gây tổn thương tế bào nhiễm kháng nguyên (virus).
Cơ sở tế bào học của quá mẫn typ IV
Khác với typ quá mẫn khác, quá mẫn typ IV không thể truyền cho cá thể khác bằng huyết thanh mà chỉ có thể truyền qua tế bào lymphô, đặc biệt là tế bào lymphô T. Gần đây người ta phát hiện có thể truyền bằng một chất có trọng lượng phân tử thấp chiết xuất từ bạch cầu gọi là yếu tố truyền Lawrence. Tuy nhiên, bản chất của chất này vẫn còn chưa biết rõ. Chất chiết xuất này có chứa nhiều yếu tố hình như có khả năng kích thích các tế bào T đã được chuẩn bị để tham gia vào phản ứng quá mẫn muộn.
Cần luôn nhớ rằng tổn thương quá mẫn là hậu quả của phản ứng quá mức giữa kháng nguyên với cơ chế miễn dịch tế bào vẫn còn bình thường. sau tiếp xúc đầu tiên, các tế bào nhớ nhận diện kháng nguyên cùng với các phân tử MHC lớp II trên đại thực bào để rồi được kích thích và chuyển dạng thành tế bào non để tăng sinh. Tế bào T đã được kích thích giải phóng nhiều yếu tố hòa tan có chức năng làm trung gian cho đáp ứng quá mẫn xảy ra sau đó nhờ thu hút và hoạt hóa đại thực bào; chúng đồng thời cũng giúp để biến các tế bào tiền thân của T gây độc trở thành các tế bào giết và gây tổn thương mô (Hình 9.12).
Tổn thương mô do phản ứng typ IV
Nhiễm trùng trên bệnh nhân lao hoặc trên tổn thương u hạt ở da của bệnh nhân phong, các tổn thương do phản ứng dị ứng với vi khuẩn như tạo, casein hóa và nhiễm độc toàn thân có lẽ do tình trạng quá mẫn qua trung gian tế bào đối với các sản phẩm vi khuẩn mà ra. Khi đấu tranh giữa sự nhân lên của vi khuẩn và sự đề kháng của cơ thể xảy ra theo chiều hướng bất lợi cho cơ thể thì các kháng nguyên vi khuẩn tồn tại trong cơ thể sẽ kích động một phản ứng quá mẫn muộn tại chỗ và mạn tính. Sự giải phóng liên tục các lymphokin bởi tế bào T dẫn đến sự tập trung của nhiều loại đại thực bào nơi có kháng nguyên xâm nhập. Một số đại thực bào sẽ tạo thành những dãy tế bào dạng biểu mô, và một số thì biến thành các tế bào khổng lồ sau khi nuốt vi khuẩn vào. Đại thực bào nào còn để lại kháng nguyên vi sinh vật trên bề mặt sẽ trở thành tế bào đích cho các tế bào giết và sẽ bị tiêu diệt. Ngoài ra, tại những nơi này, các cytokin còn gây độc trực tiếp tế bào đồng thời hoạt hóa tế bào NK để tiếp tục gây các tổn thương khác đối với mô. Toàn bộ các hoạt động vừa kể dẫn đến hình thành một hình thái tổn thương gọi là u hạt mạn tính và đây là phản ứng có lợi nhằm mục đích tạo nên một lớp vỏ bọc để khoanh khu vực tổn thương lại.
Ngoài các vi khuẩn Mycobacterium, tổn thương quá mẫn typ IV còn có thể gặp đối với các nhiễm trùng virus như virus đậu màu, sởi, herpes simplex. Một số nấm và ký sinh trùng cũng có thể gây kiểu quá mẫn này.
Viêm da tiếp xúc
Đường da là con đường thuận lợi đối với việc gây quá mẫn tế bào nhờ có nhiều tế bào Langerhans là những tế bào trình diện kháng nguyên hữu hiệu có thể nhanh chóng mang kháng nguyên đến trình diện với tế bào lympho ở hạch ngoại biên gần đó. Quả vậy, phản ứng quá mẫn muộn dễ dàng xảy ra với các hóa chất ngoại lai tiếp xúc với cơ thể qua đường da và kết hợp với các thành phần protein cơ thể trong da để trở thành kháng nguyên lạ và dễ dàng bị bắt giữ bởi tế bào trình diện kháng nguyên Langerhans, hậu quả là xảy ra phản ứng quá mẫn muộn do hóa chất này gây ra. Phản ứng viêm da tiếp xúc do quá mẫn được đặc trưng bởi sự thâm nhiễm tế bào đơn nhân đạt cường độ tối đa sau 12-15 giờ và phù nề lớp thượng bì do hình thành các nang nước nhỏ. Quá mẫn tiếp xúc có thể xảy ra ở những người làm việc với các hóa chất và trở nên mẫn cảm với các hóa chất này, ví dụ picryl chloride, pycryl chromat, p-phenylene diamin, neomycin, muối nikel là những hóa chất thường gặp có thể gây quá mẫn tiếp xúc.
Các trường hợp khác
Quá mẫn muộn cũng đã đóng góp quan trọng trong việc gây phản ứng muộn cho một số trường hợp bị côn trùng đốt. Trong trường hợp ghép cùng loài, hoạt động gây thải ghép do tế bào T gây độc là một cơ chế quan trọng, đây cũng là một thể dạng của quá mẫn typ IV. Trong một số bệnh tự miễn, người ta đã ghi nhận có vai trò của quá mẫn muộn trong cơ chế gây tổn thương.
Quá mẫn typ V – Quá mẫn kích thích
Có một số tế bào khi thực hiện chức năng cần đến sự kích thích của một loại hormone nào đó. Sự kích thích này được thực hiện thông qua một phân tử bề mặt tế bào gọi là thụ thể. Thụ thể luôn có cấu trúc đặc biệt cho chỉ hormon đó. Khi có sự kết hợp của hormon lên thụ thể, lập tức xảy ra hiện tượng biến đổi cấu trúc hóa học của thụ thể hoặc của một phân tử kế cận và sự biến đổi này phát ra một tín hiệu để truyền vào bên trong tế bào làm cho tế bào bắt đầu thực hiện chức năng của nó. Ví dụ khi hormon TSH của tuyến yên gắn vào thụ thể của nó trên tế bào tuyến giáp thì lập tức gây ra sự hoạt hóa adenyl cyclase trong màng tế bào để biến ATP thành AMP và đưa vào bên trong tế bào. AMP sau đó sẽ kích thích sự hoạt động của tế bào tuyến giáp (Hình 9.13).
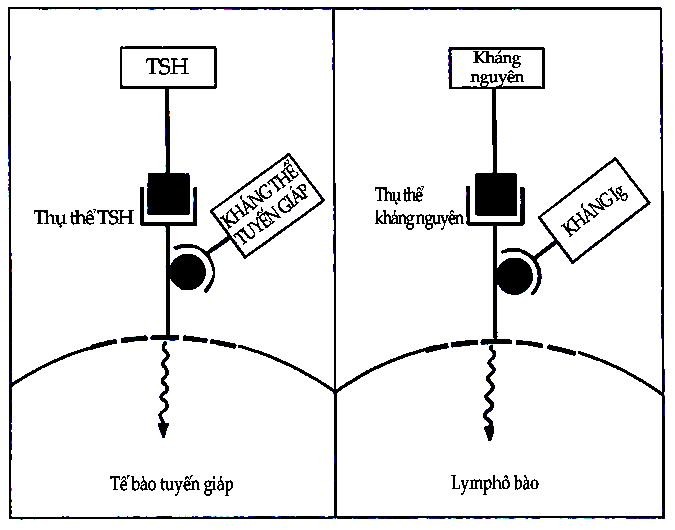
Hình 9.13. Sơ đồ cơ chế phản ứng quá mẫn typ V
Tế bào tuyến giáp được kích thích theo kiểu bình thường và bởi kháng thể. Cả hai kích thích đều tạo ra biến đổi màng và hoạt hóa tế bào.
Trên một số bệnh nhân nhiễm độc giáp, người ta thấy có kháng nguyên kích thích tuyến giáp xuất hiện trong máu. Đây là một tự kháng thể chống lại một kháng nguyên có mặt trên màng tế bào tuyến giáp. Khi tụ kháng thể kết hợp với kháng nguyên, phức hợp này cũng tạo ra kích thích giống như trường hợp THS kết hợp với thụ thể của nó, do đó chúng có khả năng làm tăng hoạt tuyến giáp qua con đường AMP vòng để gây ra chứng nhiễm độc giáp. Một điều cũng đáng lưu ý nữa là trong bệnh loét tá tràng đề kháng cimetidin, người ta cũng đã phát hiện tự kháng thể kháng thụ thể H2 của histamin.
Trên thực nghiệm, người ta đã phát hiện được thêm một số kháng thể kích thích hoạt động chức năng của tế bào qua các kháng nguyên có trên bề mặt tế bào. Ví dụ, kích thích sự chuyển dạng lympho bào T bằng kháng thể chống kháng nguyên CD3, kích thích sự phân bào của tế bào tuyến giáp bằng tự kháng thể “phát triển” (growth autoantibody), kích thích sự thực bào bằng kháng huyết thanh kháng đại thực bào, … Chúng ta cần lưu ý rằng mặc dù kháng thể chống enzyme khi gắn với enzyme ở vị trí gần diện hoạt động của nó có thể làm ức chế enzym, nhưng khi chúng gắn với quyết định ở diện hoạt động thì đôi khi lại có tác dụng tăng hoạt tính của enzym như các trường hợp của penicillinase và β-galactosidase.
Các phản ứng quá mẫn “không đặc hiệu”
Sự hoạt hóa quá mức hệ thống bổ thể theo con đường không cổ điển cũng có thể dẫn đến phản ứng quá mẫn gây ra các tổn thương tổ chức như đông máu nội mạch rải rác. Một ví dụ có thể minh họa rõ ràng cho cơ chế này là phản ứng Schwarzmann được thực hiện trên thỏ bằng cách đưa nội tố vào tĩnh mạch của thỏ . Nội độc tố hoạt hóa bổ thể theo con đường không cổ điển để rồi sau đó nó gắn với mảnh C3b và đính vào tiểu cầu nhờ kết dính miễn dịch; phức hợp C5, 6, 7 được tạo ra sẽ gây tổn thương tiểu cầu và giải phóng ra các yếu tố đông máu. Mặc dù ở người C3b có xu hướng kết dính lên hồng cầu và bạch cầu mạnh hơn tiểu cầu, nhưng trong trường hợp nhiễm trùng huyết gram âm và sốt xuất huyết có sốc cơ chế này đã đóng vai trò quan trọng trong việc gây tiêu thụ bổ thể mạnh.
Một cơ chế không đặc hiệu khác đã tham gia gây quá mẫn đó là trường hợp thiếu các protein bất hoạt C3b làm cho phản ứng hoạt hóa bổ thể không dừng lại. Ví dụ trong bệnh cảnh đái huyết cầu tố đêm kịch phát, trên màng hồng cầu bị thiếu hụ t protein khống chế C3 nên bệnh cảnh tiêu hồng cầu nặng nề đã xảy ra. Sự tiêu thụ bổ thể qúa mức hay kéo theo viêm cầu thận và rối loạn chuyể n hóa lipid ở những bệnh nhân có một yếu tố gọi là yếu tố viêm thận C3, yếu tố này có lẽ là một tự kháng thể thuộc lớp IgG có khả năng hoạt hoá bổ thể theo con đường không cổ điển.
Quá mẫn
- Tác giả: Đại học Y Hà Nội
- Chuyên ngành: Miễn dịch – Di truyền – Sinh học phân tử
- Nhà xuất bản:Đại học Y Hà Nội
- Năm xuất bản:2006
- Trạng thái:Chờ xét duyệt
- Quyền truy cập: Cộng đồng