Thiếu hụt miễn dịch
Tất cả mọi người, ai ai cũng đều bị nhiễm trùng. Khi đứa trẻ thoát ra khỏi môi trường vô trùng trong tử cung người mẹ thì lập tức bị xâm nhập bởi vô số các loài vi sinh vật. Nhưng vì hầu hết các vi sinh vật này đều không gây bệnh nên đã không tạo ra triệu chứng. Ở trẻ con, sự xâm nhập của một mầm bệnh mà chúng chưa từng tiếp xúc sẽ gây ra bệnh cảnh nhiễm trùng trên lâm sàng; nhưng đồng thời nó cũng tạo ra cho đứa trẻ một tình trạng nhớ miễn dịch và duy trì tính miễn dịch lâu dài cho đứa trẻ.
Một đứa trẻ, hay một người lớn, sẽ bị nghi ngờ là thiếu hụt miễn dịch (THMD) khi trên cơ thể xuất hiện những nhiễm trùng lặp đi lặp lại, tồn tại kéo dài, trầm trọng hoặc bất thường. Thiếu hụt miễn dịch có thể chia thành tiên phát hoặc thứ phát, và có thể xảy ra theo cơ chế đặc hiệu hoặc không đặc hiệu. Tuy nhiên, có nhiều thiếu hụt có thể mơ hồ, thoáng qua hoặc không phân loại được. Theo một báo cáo thống kê thì hơn một nửa số bệnh nhân bị nhiễm trùng lặp đi lặp lại hoàn toàn bình thường về mặt miễn dịch học. Trong khi đó khoảng 45% có biểu hiện ít nhất là một kiểu thiếu hụt chức năng miễn dịch, mà chiếm phần lớn là thiếu hụt miễn dịch không đặc hiệu (Hình 10.1) .
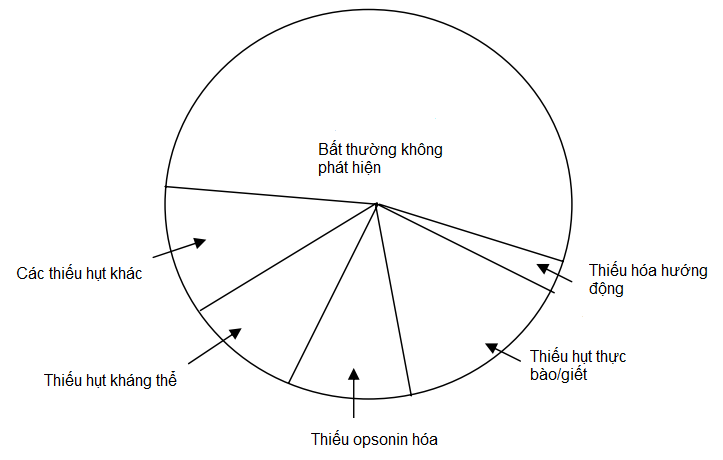
Hình 10.1. Phân bố nguyên nhân của nhiễm trùng lặp đi lặp lại ở trẻ em
Thiếu hụt miễn dịch tiên phát
Thiếu hụt kháng thể (THKT) tiên phát
Chẩn đoán thiếu hụt kháng thể tiên phát ở trẻ em
Thiếu hụt khả năng sinh tổng hợp kháng thể có thể xảy ra ở khía cạnh số lượng hoặc chất lượng: thiếu hụt về số lượng có thể xảy ra cho tất cả các lớp kháng thể (thiếu hụt toàn phần) hoặc chỉ một lớp hoặc tiểu lớp (thiếu hụt chọn lọc) (Bảng 10.1). Thiếu hụt kháng thể có thể gặp cả ở trẻ em lẫn người lớn; tuy nhiên, các kiểu thiếu hụt ở hai lứa tuổi này thường không giống nhau và do đó không được trình bày chung với nhau.
Bảng 10.1. Phân loại thiếu hụt kháng thể tiên phát
| Giảm gammaglobulin màu toàn phần ở trẻ em
Giảm gammaglobulin máu có liên quan giới tính Giảm gammaglobulin máu nhiễm sắc thể thường thể lặn Thiếu hụt miễn dịch biến đổi thường gặp Thiếu hụt Ig có tăng IgM Thiếu hụt miễn dịch với u tuyến ức Thiếu hụt kháng thể với mức Ig bình thường Thiếu hụt IgA chọn lọc Thiếu hụt IgM chọn lọc Thiếu hụt tiểu lớp Ig chọn lọc Thiếu hụt chuỗi kappa |
Việc khai thác tiền sử kỹ có thể giúp chúng ta phân biệt những thể thiếu hụt miễn dịch tiên phát hiếm gặp với những nguyên nhân thường gặ̣p của nhiễm trùng lặp đi lặp lại. Ví dụ, xơ hóa nang hoặc dị vật đường thở là nguyên nhân thường gặp của nhiễm trùng hô hấp ở trẻ con.
Thông tin do khai thác tiền sử: nhiễm trùng lặp đi lặp lại ở đường hô hấp xảy ra trên hầu hết bệnh nhân thiếu hụt miễn dịch. Nhiều bệnh nhân có nhiễm trùng da (nhọt, ép xe, viêm mô tế bào), viêm màng não hoặc viêm khớp. Vi sinh vật thường hay gây nhiễm trùng nhất trong thiếu hụt miễn dịch là các vi khuẩn sinh mủ như tụ cầu, hemophilus influenzae và streptococcus pneumoniae (Hình 10.2). Nhìn chung, những bệnh nhân này thường không dễ bị nhiễm nấm hoặc virus vì miễn dịch tế bào vẫn được bảo tồn, tuy nhiên ngoại lệ vẫn có thể xảy ra.
Đối với những trường hợp thiếu hụt kháng thể bẩm sinh, nhiễm trùng tái đi tái lại bắt đầu xuất hiện trong khoảng thời gian từ tháng thứ 4 đến 2 tuổi còn thời gian trước đó nhờ có kháng thể từ mẹ truyền sang nên trẻ không mắc bệnh. (Hình 10.3).
Việc nghiên cứu tiền sử gia đình đôi lúc cũng tỏ ra có giá trị chẩn đoán đối với một số bệnh có tính di truyền. Tuy nhiên, cần lưu ý rằng hiện nay số con cái trong mỗi gia đình bị giảm đi trong một số quốc gia vì thế mà một tiền sử gia đình âm tính không loại trừ được khả năng của một bệnh di truyền.
Thông tin thu được qua thăm khám: Rất hiếm khi có triệu chứng thực thể mang tính chẩn đoán đối với bệnh thiếu hụ t kháng thể mặc dù thăm khám có thể giúp tìm thấy hậu quả của các nhiễm trùng trầm trọng trước đó, ví dụ như màng nhĩ thủng, dãn phế quản, v.v… Một hình ảnh thường gặp là chậm phát triển.
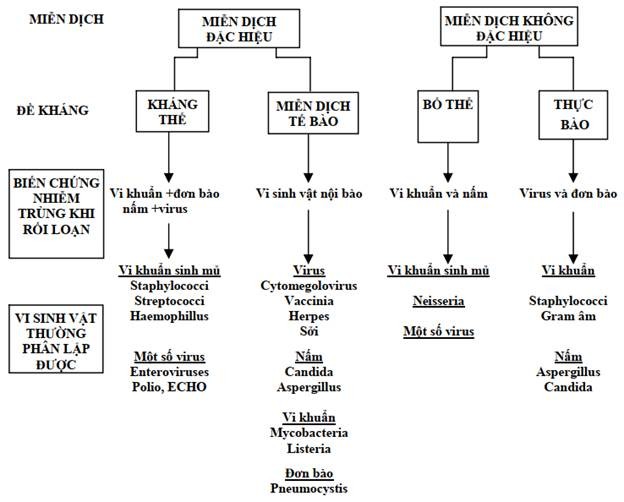
Hình 10.2. Tương quan giữa thiếu hụt miễn dịch với các loạivi sinh vật gây bệnh
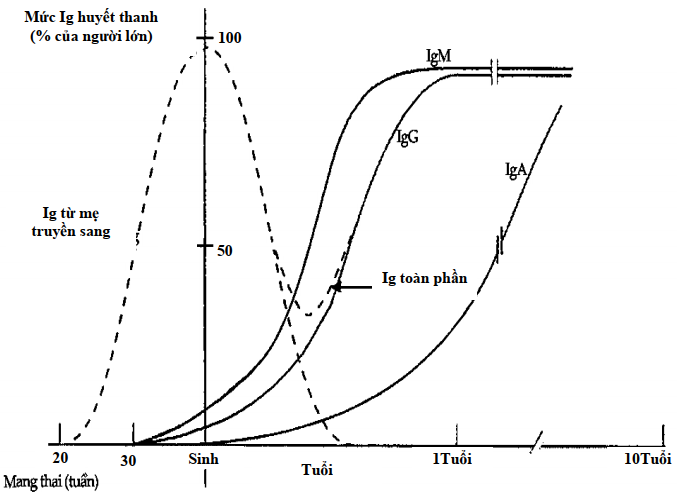
Hình 10.3. Nồng độ immunoglobulin theo tuổi
IgG truyền từ mẹ sang hầu như biến mất vào tháng thứ 6. Khi trẻ chủ động tổng hợp IgG, số lượng tăng rất chậm nên ta có thể thấy hình ảnh máng xối vào giữa tháng thứ 3 và tháng thứ 6 đối với IgG toàn phần.
Xét nghiệm cận lâm sàng rất cần thiết cho chẩn đoán. Định lượng các Ig huyết thanh sẽ cho hình ảnh bệnh lý khá rõ. Rất ít khi gặp trường hợp thiếu hoàn toàn Ig, ngay cả trong những trường hợp trầm trọng thì vẫn còn phát hiện được một lượng nhỏ IgG và IgM.
So với định lượng Ig toàn phần thì đánh giá kh ả năng sản xuất kháng thể của bệnh nhân cho chỉ dẫn tốt hơn về khả năng nhiễm trùng của bệnh nhân. Một số cá thể cho thấy mất khả năng tạo kháng thể đặc hiệu sau khi tiêm chủng trong khi lượng Ig huyết thanh vẫn bình thường. Các xét nghiệm về chức năng kháng thể bao gồm: (1) phát hiện hoạt tính tự nhiên của kháng thể; và (2) đáp ứng với tiêu chuẩn thử nghiệm.
Ngoài ra người ta còn đếm số lượng tế bào B lưu động qua phát hiện phân tử Ig trên bề mặt tế bào này (sIg). Trong máu bình thường, số tế bào sIg+ chiếm khoảng 5-15% tổng số lymphô. Sự vắng mặt của tế bào B trên một bệnh nhân thiếu hụt kháng thể giúp phân biệt bệnh giảm Ig máu liên quan giới tính ở trẻ con với các nguyên nhân khác của thiếu hụt kháng thể tiên phát là các bệnh mà trong đó số lượng tế bào B vẫn bình thường hoặc có giảm nhưng không mất hẳn.
Nguyên nhân chính của THKT tiên phát ở trẻ em – Giảm Ig máu thoáng qua ở trẻ em
IgG mẹ được truyền chủ động qua nhau thai đến tuần hoàn phôi bắt đầu từ tháng thứ tư của thai kỳ và lượng truyền này đạt tối đa vào 2 tháng cuối. Khi mới sinh trẻ có một lượng IgG ít nhất là bằng lượng của mẹ đã truyền sang. Sau đó lượng IgG mẹ thoái hóa sẽ được thay thế bằng sự sinh tổng hợp IgG của cơ thể con, nhưng vì trẻ không tổng hợp ngay được một lượng lớn nên ở giữa tháng thứ 3 và tháng thứ 6 xuất hiện một thời kỳ “giảm Ig máu sinh lý”. Trẻ bình thường thì không dễ bị nhiễm trùng trong thời kỳ này vì kháng thể có chức năng hoạt động tốt dù số lượng IgG có giảm sút; hơn nữa, chức năng tế bào T vẫn còn nguyên vẹn. Tuy vậy, sự giảm IgG có thể nặng hơn nếu lượng IgG nhận từ mẹ còn ít như trong trường hợp đẻ non chẳng hạn.
Giảm Ig máu thoáng qua cũng xảy ra khi đứa trẻ chậm tổng hợp IgG cho cơ thể, trong khi lượng IgG mẹ tiếp tục giảm, lúc đó trẻ có thể bị nhiễm trùng sinh mủ tái đi tái lại. Điều quan trọng là cần phân biệt bệnh cảnh này với bệnh lý thiếu hụt kháng thể thật sự vì việc điều trị chúng không giống nhau. Trong đa số các trường hợp, trẻ vẫn khỏe và không cần điều trị đặc hiệu. Nếu có nhiễm trùng nặng cần bổ sung Ig để đề phòng tử vong. Điều trị có thể kéo dài 1-2 năm hoặc cho đến khi cơ thể sinh tổng hợp đủ IgG.
Giảm Ig liên quan giới tính ở trẻ em (bệnh Bruton)
Trẻ nam mắc bệnh này thường có nhiễm trùng sinh mủ lặp đi lặp lại vào khoảng tuổi 4 tháng đến 2 năm. Vùng và cơ quan bị nhiễm trùng cũng giống như trong những trường hợp thiếu hụt kháng thể khác.
Trên đa số thường hoặc thậm chí còn tăng. Không tìm thấy tương bào trong tủy xương, hạch bạch huyết hay đường tiêu hóa. Tất cả những điều này nói lên tình trạng thiếu hụt một “vi môi trường” cần thiết cho sự hình thành tế bào B, mặc dù cơ chế chính xác vẫn chưa được rõ.
Chẩn đoán dựa vào nồng độ rất thấp của tất cả các lớp Ig trong huyết thanh, vắng mặt tế bào B lưu động và tiền sử mắc bệnh của những trẻ nam khác trong dòng họ. Tuy nhiên, cũng có khi yếu tố di truyền không rõ ràng. Gen bị tổn thương hiện nay đã được xác nhận là nằm trên đoạn gần của cánh dài của nhiễm sắc thể X. Điều trị bao gồ m liệu pháp bù đắp Ig cho trẻ bệnh, hoặc xử lý gen cho bào thai vì hiện nay việc chẩn đoán bệnh trước khi sinh là việc hoàn toàn có thể thực hiện được.
Thiếu hụt miễn dịch biến đổi thường gặp (common variable immunodeficieny, CVI)
Thuật ngữ này dùng để chỉ một nhóm bệnh thiếu hụt miễn dịch khá đa dạng xuất hiện ở trẻ con hoặc người lớn. Tuy nhiên, đa số bệnh nhân được chẩn đoán trước tuổi trưởng thành.
Thiếu hụt IgA chọn lọc
Đây là thiếu hụt tiên phát thường gặp nhất đối với miễn dịch đặc hiệu, chiếm tỉ lệ trong nhân dân là 1/700 ở Anh. Bệnh có thể xuất hiện ở bất cứ lứa tuổi nào và được đặc trưng bởi nồng độ IgA huyết thanh rất thấp trong khi nồng độ IgM và IgG vẫn bình thường. Nhiều người bị thiếu hụt IgA vẫn sống khỏe mạnh bình thường và ta chỉ tình cờ phát hiện trong những đợt kiểm tra máu định kỳ. Tuy nhiên nhìn chung thì người thiếu hụt IgA vẫn có một số biểu hiện lâm sàng bất thường và rất đa dạng (Hình 10.5).
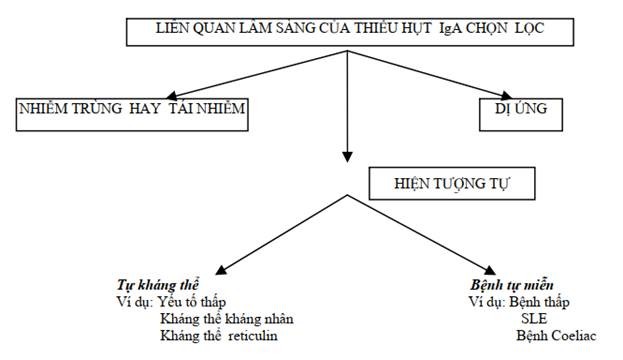
Hình10.5. Những rối loạn thường đi kèm với thiếu hụt IgA
Trên khoảng 1/3 số người bị thiếu hụt IgA, người ta phát hiện thấy có kháng thể kháng IgA. Mộ t số trong nhóm này xuất hiện phản ứng không may khi được truyền máu hoặc plasma do đó chúng ta cần xem việc định lượng IgA như một việc thường quy khi theo dõi phản ứng truyền máu.
Thiếu hụt tiểu lớp IgG
Thiếu hụt một hay nhiều tiểu lớp IgG là điều thường hay bị bỏ qua bởi vì nồng độ tương đối cao của IgG1 (khoảng 70%) có thể che l ấp sự thiếu hụt các tiểu lớp khác và ta vẫn đo được một nồng độ IgG gần như bình thường.
Tất cả các trường hợp thiếu h ụt tiểu lớp của IgG đều dễ gây ra nhiễm trùng hô hấp. Tuy nhiên hoạt tính kháng thể chủ yếu có thể tập trung vào một tiểu lớp nào đó. Ví dụ, IgG2 chiếm ưu thế trong đáp ứng kháng thể chống các kháng nguyên polysaccharid của Streptococcus pneumoniae và Haemophilus influenzae, do đó nếu thiếu hụt IgG2 thì dễ gây ra nhiễm trùng đường hô hấp lập đi lập lại, nhiễm trùng huyết hoặc viêm màng não do pneumococcus. Ngoài ra, chúng ta cần phải lưu ý thêm rằng, một đáp ứng tạo IgG1 sau khi gây miễn dịch không loại trừ sự thiếu hụt IgG2.
Thiếu hụt IgG2 có thể xảy ra kèm với thiếu hụt IgA và IgG4. Những người bị thiếu hụt kết hợp này dễ dàng mắc bệnh phổi hơn là chỉ bị thiếu hụt một mình IgA. Thiếu hụt IgG1 và IgG3 thường hay phối hợp với nhau và gây ra đáp ứng miễn dịch yếu đối với kháng nguyên có bản chất protein như kháng nguyên trong vi khuẩn bạch hầu hoặc uốn ván.
Cũng có khi người ta ghi nhận sự phối hợp bất thường giữa thiếu hụt các tiểu lớp IgG với bệnh cảnh trông có vẻ như không có liên quan như động kinh trẻ con, tuy nhiên sự liên hệ này có tính nhân qủa không thì chưa được rõ.
Chẩn đoán phân biệt
Triệu chứng chủ yếu của thiếu hụt miễn dịch là nhiễm trùng tái phát luôn, nhưng thiếu hụt kháng thể tiên phát là bệnh hiếm gặp do đó mà chẩn đoán phân biệt không dễ dàng. Nếu nhiễm trùng tái phát ở một vị trí duy nhất thì nguyên nhân có lẽ chỉ khu trú tại chỗ. Ví dụ, viêm màng não tái đi tái lại thường là do sự thông thương giữa xoang với dịch não tủy, trong lúc đó viêm phổi tái đi tái lại thì có thể do xơ hóa nang hoặc dị vật đường thở.
Giảm gammaglobulin máu thứ phát có thể xảy ra sau nhiều rối loạn khác nhau và nhiều sách giáo khoa đã liệt kê ra một bảng danh mục về nguyên nhân khá dài. Tuy nhiên, đứng trên quan điểm thực hành, bảng liệt kê này tỏ ra chẳng giúp ích gì nhiều. Ví dụ, mặc dù hội chứng thận hư tương đối thường gặp ở trẻ con (so với thiếu hụt miễn dịch tiên phát) và chắc chắn gây ra hàm lượng Ig thấp cho bệnh nhân, nhưng nhiễm trùng tái đi tái lại không phải là một vấn đề trầm trọng ở đây.
Biến chứng của thiếu hụt kháng thể
Bệnh nhân thiếu hụt miễn dịch dễ mắc khá nhiều kiểu biến chứng:
Nhiễm trùng mạn tính đường hô hấp dẫn đến viêm mạn tính ở tai giữa, viêm xoang, dãn phế quản, xơ hóa phổi và cuối cùng là tâm phế mạn.
Bệnh tiêu hóa nhẹ xảy ra ở 2/3 số bệnh nhân người lớn bị thiếu hụt kháng thể. Hội chứng giống thiếu máu ác tính tương đối phổ biến và khác với thiếu máu ác tính cổ điển ở chỗ không có kháng thể kháng tế bào thành dạ dày và kháng yếu tố nội; viêm dạ dày teo đét xảy ra trên toàn bộ dạ dày không ngoại trừ vùng hang vị và lượng gastrin huyết thanh thấp hơn. Triệu chứng ỉa chảy có kèm hoặc không kèm kém hấp thu xảy ra là do nhiễm giardia lamblia, vi khuẩn này phát triển mạnh trong ruột non hoặc do nhiễm trùng dai dẳng crytosporidum, campylobacter, rotavirus hoặc enterovirus. Trên một số người lớn có thiếu hụt miễn dịch biến đổi thường gặp, có thể có tăng sinh tổ chức lympho đường tiêu hóa. Sự tăng sinh này lành tính mặc dù đôi khi chỗ tăng sinh lớn đến mức có thể gây tắc ruột. Viêm đường mật mãn tính có thể xảy ra do nhiễm trùng ngược dòng ở đường mật: một số trường hợp có thể dẫn đến xơ gan.
Bệnh lý khớp có thể gặp trên khoảng 12% các trường hợp thiếu hụt kháng thể. Viêm khớp nhiễm trùng mà đặc biệt là do Mycoplasma hoặc ureaplasma cần phải loại trừ. Một số bệnh nhân bị viêm đa khớp mãn tính ở các khớp lớn, một số khác bị viêm một khớp không đặc hiệu và một số thiểu số bị thấp khớp đặc hiệu v ới viêm khớp loét và hạt thấp dưới da nhưng không có yếu tố thấp. Theo kinh nghiệm thì khó mà chẩn đoán nhầm bệnh nhân thiếu hụt kháng thể với bệnh Still hoặc viêm khớp dạng thấp.
Nhiễm trùng virus ở hệ thần kinh trung ương hiếm gặp trong CVI, nhưng những trẻ bị giảm gammaglobulin huyết liên quan giới tính thì dễ nhiễm virus ECHO mạn tính. Điều này có thể gây ra viêm não-màng não nặng và dai dẳng, đôi khi có hộ i chứng giống viêm da cơ. Bệnh này thường dẫn đến tử vong mặc dù có điều trị bằng liệu pháp truyền Ig.
Bệnh nhân thiếu hụt miễn dịch thể và hoặc tế bào có tăng khả năng mắc bệnh ác tính từ 10 đến 200 lần. Đa số các u có nguồn gốc lympho-lưới, mặc dù cũng có khi gặp u dạ dày sau khi có viêm dạ dày thể teo đét.
Điều trị thiếu hụt kháng thể
Chẩn đoán trước là điều cần thiết để hạ thấp tỉ lệ biến chứng.
Liệu pháp thay thế Ig là điều cần thiết cho bệnh nhân thiếu hụt kháng thể. Hiện nay trên thị trường luôn sẵn có các chế phẩm Ig tiêm bắp.
Người ta thường sản xuất các chế phẩm này từ huyết thanh của máu nhiều người cho trộn lại sản phẩm được khử trùng đối với các virus truyền theo đường máu, nhất là HIV. Chấ t chiếm đa số trong sản phẩm là IgG và hoạt tính kháng thể là hoạt tính của huyết thanh trộn lẫn. Các chế phẩm kiếu này thường không bao giờ người ta tiêm tĩnh mạch. Liều Ig phụ thuộc vào trọng lượng của bệnh nhân. Bệnh nhân mới được chẩn đoán nên cho 50mg/kg trọng lượng/ngày trong 5 ngày, sau đó 25mg/kg/tuần.
Có điều cần lưu ý là việc tiêm bắp Ig có nhiều nhược điểm. Nhược điểm lớn nhất là khoảng 20% người dùng bị phản ứng toàn thân. Phản ứng xảy ra trong vòng vài phút sau khi tiêm giống như một phản ứng phản vệ cổ điển tức là gây ra do sự kết tập IgG làm hoạt hóa bổ thể và tấn công tế bào mast gây mất hạt. Tác dụng phụ tại chỗ bao gồm đau, tổn thương dây thần kinh và hình thành các áp xe vô trùng. Ngoài ra, sự hấp thụ Ig theo đường tiêm bắp rất thay đổi và có liên quan đến số lượng tiêm vào. Do đó trong liệu pháp này không nên để lượng IgG huyết thanh vượt quá 2-3g/l.
Các sản phẩm Ig tiêm tĩnh mạch hiện nay trên thị trường có nhiều ưu điểm: (1) có thể cho liều lớn hơn do đó nồng độ IgG huyết thanh có thể đạt mức cao hơn; (2) truyền tĩnh mạch ít gây đau và không cần phải tiêm nhiều lần; (3) ít gặp phản ứng phụ. Như vậy ta có thể thấy rằng việc điều trị có thể tiến hành ở nhà như trong trường hợp điều trị bệnh ưa chảy máu bằng truyền yếu tố VIII.
Hiệu quả của Ig tĩnh mạch trong việc làm giảm tần số và độ trầm trọng của nhiễm trùng phụ thuộc vào liều sử dụng. Cho liều 0,4g/kg cân nặng mỗi 3-4 tuần có thể giúp để đạt nồng độ IgG huyết thanh 5g/l sau 3-6 tháng. Nhược điểm chính của Ig tĩnh mạch là có thể truyền bệnh viêm gan không-A không-B, và giá thành tương đối đắt.
Các phương tiện điều trị chung bao gồm phát hiện và chẩn đoán sớm các trường hợp bệnh mới. Cần phải phân biệt một số bệnh cảnh dễ nhầm với biến chứng của giảm gammaglobulin huyết như dị vật đường thở có thể bị bỏ qua trên trẻ thiếu hụt kháng thể có triệu chứng đường hô hấp. Bệnh nhân thiếu hụt kháng thể cho đáp ứng nhanh với kháng sinh thích hợp nhưng chúng ta không nên dùng kháng sinh trước 10-14 ngày.
Thiếu hụt miễn dịch tế bào tiên phát
Các kiểu thiếu hụt
Thiếu hụt chức năng tế bào T đơn thuần (Hình 10.6) hiếm gặp: thông thường, suy giảm tính miễn dịch của tế bào T thường đi kèm với các bất thường của chức năng tế bào B, nói lên sự tương tác tế bào T-B cần thiết cho sự sinh tổng hợp kháng thể đối với hầu hết kháng nguyên. Khác với thiếu hụt kháng thể, suy giảm miễn dịch tế bào xuất hiện trong vòng 6 tháng đầu của trẻ. Ví dụ, vào tháng thứ ba và thứ tư, hội chứng DiGeorge có thể xuất hiện với các triệu chứng nặng nề như co giật, dị tật đường tim mạch chứ không phải do nhiễm trùng.
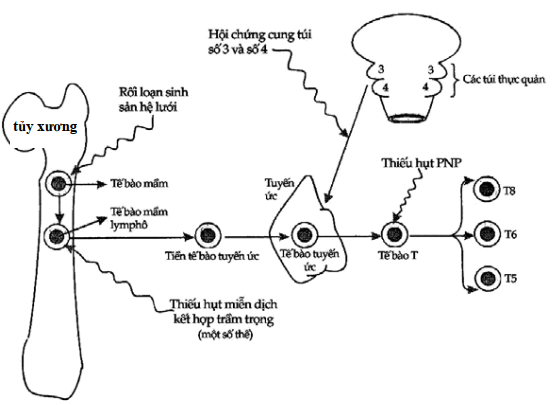
Hình 10.6. Sơ đồ các giai đoạn trưởng thành tế bào T và những vị trí mà thiếu hụt miễn dịch tế bào có thể xảy ra
Trên một số trẻ người ta thấy có hiện tượng mất chức năng của tế bào B lẫn tế bào T, đó là thiếu hụt miễn dịch kết hợp nặng (severe combined immunodeficiency, SCID). SCID có nhiều biến thể khác nhau được phân biệt dựa trên sự thiếu hụt enzym, cách thức di truyền và mức độ sai sót trong biệt hóa. Những trẻ mắc hội chứng này hầu như đều có triệu chứng đi chảy mạn tính và không phát triển trong những tuần tuổi đầu tiên. Người ta chỉ lưu ý đến bệnh khi thấy trẻ có nhiều đợt “ viêm dạ dày – ruột”. Ghép tủy tỏ ra có hiệu quả trong việc điều chỉnh khiếm khuyết miễn dịch trong trường hợp này. Chúng ta cần lưu ý rằng những bất thường về enzym của con đường chuyển hóa purine (ví dụ như adenosine deaminase, purine nucleoside phosphorilase) cũng thể hiện thành thiếu hụt miễn dịch do các chất chuyển hóa độc hại tích tụ trong tế bào T và B. Thiếu hụt adenosine deaminase có thể kết hợp với thiếu gammaglobulin máu thoáng qua ở trẻ con.
Xử trí thiếu hụt miễn dịch tế bào (Bảng 10.2)
Phát hiện sớm là điều cực kỳ thiết yếu. Phòng ngừa thiếu hụt thường là tốt hơn điều trị và người ta thường khuyên là nên cho khảo sát gen của những đứa trẻ trong gia đình nghi ngờ có thể bị thiếu hụt miễn dịch di truyền. Trong trường hợp phát hiện thấy trong nhà có người bị thiếu hụt enzym, chúng ta có thể tiến hành phát hiện người mang gen bệnh cũng như phát hiện bệnh trước sinh. Ví dụ trong thiếu hụt adenosine deaminase, chẩn đoán trước sinh có thể thức hiện bằng cách do hoạt tính adenosine deaminase (ADA) trong tế bào xơ của nước ối.
Bảng 10.2. Các biện pháp xử trí đối với thiếu hụt miễn dịch tế bào.
| Biện pháp chung
Khảo sát di truyền Chẩn đoán trước sinh Tránh tiêm chủng với vắc-xin sống Tránh truyền máu ( nếu cần truyền thì phải chiếu xạ máu truyền trước) Ghép các mô có khả năng tạo miễn dịch Ghép tủy, ghép tế bào gốc (mầm) Ghép tuyến ức phôi Ghép gan phôi Thay thế thành phần bị thiếu hụt Các chất chiết xuất tế bào Hormon tuyến ức Yếu tố truyền (transfer factor) Thay thế enzym Liệu pháp gen |
Cần tránh tiêm chủng với vắc-xin sống hoặc truyền máu cổ điển đối với bệnh nhân có nghi ngờ thiếu hụt miễn dịch tế bào: vắc-xin sống có thể dẫn đến nhiễm trùng lan tỏa và truyền máu có thể gây ra bệnh ghép chống chủ trừ khi máu đã được chiếu xạ trước khi truyền.
Ghép tế bào có thẩm quyền miễn dịch cho ta một hy vọng duy nhất là duy trì thường xuyên đáp ứng miễn dịch thay thế trong cơ thể. Ghép tủy là điều trị chọn lựa đối với SCID và một số thiếu hụt khác nhưng nó cũng có thể gây ra một số nguy hiểm như bệnh ghép chống chủ chẳng hạn. Để thay cho việc ghép tủy tức là truyền các tế bào mầm, người ta đã đưa ra một phương pháp khác là các mô lấy từ các phôi sống vì các mô này không gây biến chứng như trên. Người ta đã dùng gan phôi và tuyến ức phôi vào mục đích này, nhưng chẳng may cả hai loại đều có thể gây bệnh ghép chống chủ nặng có thể làm chết người dù rất hiếm khi xảy ra.
Thay thế các yếu tố bị thiếu là biện pháp hợp lý nhưng thành công rất hạn chế. Trong những năm gần đây người ta đã cho ra đời nhiều loại tinh chất tuyến ức, nhưng qua điều trị thử đối với thiếu hụt miễn dịch tế bào tiên phát chưa có chế phẩm nào cho kết quả mong muốn. Biện pháp thay thế enzym cho những bệnh nhân thiếu men adenosine deaminase (ADA) hoặc purine nucleoside phosphorilase (PNP) cũng chỉ cho một kết quả hạn chế. Chế phẩm dùng hồng cầu chứa ADA và PNP cho đông lạnh và chiếu xạ là một nguồn tốt cung cấp các enzym này nhưng kết quả điều trị so với ghép tủy cũng chẳng tốt hơn. Truyền hồng cầu là một biện pháp “cầm chân” chứ không phải là biện pháp điều trị.
Thiết lập bản đồ gen đối với các gen ADA, PNP, và MHC đã được tiến hành ở một s ố cơ sở nghiên cứu, và người ta cũng đã nhân được các gen tương ứng để lưu giữ như một nguồn cung cấp. Đồng thời người ta cũng đã thành công trong việc cấy gen ADA vào cho một retrovirus để các tế bào được cho nhiễm virus này có thể sản xuất được hoạt tính ADA người. Có lẽ thiếu hụt ADA và PNP sẽ là các bệnh lý người đầu tiên được điều trị bằng biện pháp truyền gen mặc dù hậu quả lâu dài (ví dụ như nguy cơ mắc ung thư do đưa DNA của retrovirus vào genom của người) thì vẫn còn chưa rõ.
Thiếu hụt miễn dịch không đặc hiệu tiên phát
Hoạt động miễn dịch dịch thể không chỉ phụ thuộc sự sinh tổng hợp kháng thể mà còn phụ thuộc vào các cơ chế loại trừ kháng nguyên đã được gắn với kháng thể trong đó sự loại trừ kháng nguyên bằng bổ thể và bằng thực bào là hai cơ chế rất quan trọng. Sự ly giải vi khuẩn phụ thuộc bổ thể cần đến sự ho ạt hóa và cố định bổ thể. Các vi sinh vật được gắn IgG (tức là được opsonin hóa) sẽ sẵn sàng để được tiêu hóa bởi các tế bào thực bào. Như vậy, hoạt động miễn dịch đặc hiệu cần đến các cơ chế hiệu quả không đặc hiệu để hoàn thành nhiệm vụ của mình một cách trọn vẹn: sự phụ thuộc này phần nào giải thích các biến chứng nhiễm trùng mà bệnh nhân mắc phải khi không bị thiếu hụt sinh tổng hợp kháng thể nhưng thiếu hụt chức năng tế bào trung tính (Hình 10.2 )
Thiếu hụt chức năng tế bào trung tính
Chức năng chính xác của tế bào trung tính là ăn, giết và tiêu hóa các vi sinh vật xâm nhập vào cơ thể, nhất là vi khuẩn và nấm. Nếu chức năng này không thực hiện được thì nhiễm trùng xảy ra. Thiếu hụt chức năng tế bào trung tính có thể do thiếu hụt số lượng (chứng giảm bạch cầu trung tính) hoặc thiếu hụt chất lượng (chứng rối loạn chức năng neutrophil). Tuy nhiên, về mặt lâm sàng thì cả hai loại thiếu hụt có thể giống nhau và thường mang tính chất toàn thân. Thực vậy, nhiễm trùng ở đây có các biểu hiện sau:
Lặp đi lặp lại và kéo dài
Hình ảnh lâm sàng có thể nghèo nàn mặc dù nhiễm trùng rất nặng
Đáp ứng kép với kháng sinh
Nguyên nhân thường gặp nhất là tụ cầu
Nhiễm trùng bao giờ cũng có ở da và niêm mạc
Bệnh gây nhiễm trùng sinh mủ ở mạch bạch huyết.
Chứng giảm bạch cầu trung tính thường gặp hơn rối loạn chức năng neutrophil và giảm thứ phát thì thường gặp hơn giảm tiên phát. Chứng này cũng đồng thời là hiệu ứng thứ phát thường gặp của liệu pháp hóa học chống ung thư. Lượng neutrophil lưu động bình thường khoảng 1.5 triệu/ml. Khi có giảm nhẹ tế bào trung tính, triệu chứng thường không có, nhưng khi giảm vừa rồi nặng thì nguy cơ cũng như độ trầm trọng của triệu chứng nhiễm trùng tăng lên rõ rệt. Nhiễm trùng có thể đe dọa tính mạng khi lượng neutrophil xuống dưới 500.000/ml. Giảm bạch cầu trung tính tiên phát thường hiếm gặp. Còn các dạng bẩm sinh có thể gây ra từ bệnh cảnh nhẹ nhất là “giảm neutrophil mạn lành tính” đến nặng nhất là gây tử vong nhanh.
Chứng rối loạn chức năng neutrophil có thể chia thành thiếu hụt giai đoạn phát triển và thiếu hụt chất lượng t ế bào tùy theo sự thiếu hụt xảy ra ở khâu nào (Bảng 10.3). Hiện tượng giảm độ di động neutrophil có thể xảy ra mà không gây ra sai sót trong khả năng thực bào. Chức năng opsonin hóa kém do thiếu hụt kháng thể hoặc lượng C3 thấp do một nguyên nhân nào đó cũng có thể làm tăng khả năng nhiễm trùng.
Khi cơ chế diệt khuẩn nội bào bị mất, vi khuẩn có thể tồn tại và tăng sinh bên trong tế bào, tránh được tấn công của kháng thể và các loại kháng sinh. Bệnh cảnh đặc trưng cho trường hợp này là bệnh u hạt mãn tính (chronic granulomatous disease, CGD). CGD là một nhóm bệnh xảy ra do giảm sản xuất các gốc oxy diệt khuẩn xảy ra trong quá trình tăng cường hô hấp của hoạt động thực bào. Trong nhóm này có nhiều dạng di truyền. Dạng cổ điển là rối loạn di truyền lặn liên quan đến giới tính xảy ra điển hình vào 2 tháng đầu của đời sống với nhiễm trùng da nặng do tụ cầu vàng, vi khuẩn gram (-) hoặc nấm. Biến chứng thường gặp gồm viêm hạch bạch huyết vùng tương ứng, gan lách lớn, áp xe gan và viêm xương tủy. Trong cơ quan tổn thương thấy hình ảnh đa áp xe và u hạt tế bào khổng lồ không casein hóa.
Xét nghiệm sàng lọc đơn giản nhất đối với CGD là thử nghiệm dùng nitroblue tetrazolium (NBT) để đánh giá khả năng tế bào hạt sản xuất các gốc superoxide trong quá trình thực bào.
Bảng 10.3. Các kiểu thiếu hụt chức năng neutrophilchủ yếu gây ra nhiễm trùng tái phát nhiều lần
| Bệnh/Hội chứng | Hình ảnh lâm sàng | Kiểu thiếu hụt |
| Bệnh u mạn tính | Nhiễm trùng gram (+) có catalase
Hình thành u hạt |
↓ Chuyển hóa qua phản ứng oxy hóa
↓ Hoạt tính diệt khuẩn |
| Hội chứng tăng IgE và nhiễm trùng tái diễn |
Hình ảnh gương mặt thô
Nhiễm candida da – niêm mạc Tăng IgE huyết thanh Áp xe phổi, thoát vị phổi (pneumatocele) |
Bất thường hóa hướng động |
| Hội chứng Chediak -Higashi |
Hạt tiêu thể khổng lồ trong tế bào tiết
Bạch tạng mắt-da từng phần |
Bất thường hóa hướng động
Diệt khuẩn chậm |
| Thiếu hụt thụ thể CR3 |
Cuốn rốn rụng chậm
Nhiễm trùng da và viêm lợi Áp xe sâu, viêm phúc mạc, viêm xương – tủy |
↓ Thực bào
↓ Kết dính |
Thiếu hụt bổ thể
Biến đổi chức năng bổ thể thường xảy ra thứ phát sau những bệnh có tiêu thụ bổ thể qua đường cổ điển hoặc không cổ điển. Một ví dụ thường được đề cập là: trong bệnh lupus ban đỏ hệ thống, khả năng hòa tan phức hợp miễn dịch của bổ thể bị biến đổi ở những mức độ nặng nhẹ khác nhau tùy thuộc vào độ trầm trọng của bệnh. Ngoài ra, sự tiêu thụ bổ thể theo đường cổ điển đối với các yếu tố C1, C4 và C2 trong bệnh Luput ban đỏ hệ thống còn có thể làm giảm khả năng trung hòa hoặc ly giải một số virus.
Ở người, thiếu hụt di truyền các thành phần bổ thể thường đi kèm với những hội chứng lâm sàng đặc trưng. Những bệnh nhân thiếu hụt C1, C4 hoặc C2 thường thể hiện hội chứng giống lupus (với các triệu chứng như ban hình cánh bướm, đau khớp, viêm cầu thận, sốt) hoặc viêm mạch mạn tính nhưng hiếm khi thể hiện thành nhiễm trùng sinh mủ, tái phát nhiều lần. Kháng thể kháng nhân và kháng DNA chuỗi kép thường không có. Thiếu hụt những thành phần sớm này của con đường cổ điển có thể làm cho cơ thể khó khăn trong loại trừ kháng nguyên virus và dễ dẫn đến bệnh phức hợp miễn dịch do sự tồn tại dai dẳng của kháng nguyên trong cơ thể.
Bệnh thiếu hụt C3 có thể là tiên phát hoặc cũng có khi th ứ phát sau thiếu hụt các chất ức chế C3b như yếu tố I (C3b inactivator), yếu tố H (beta1 H globulin). Người mắc chứng này thường biểu hiện khả năng dễ bị nhiễm khuẩn tái phát nhiều lần và gây nguy hiểm cho tính mạng như bị viêm phổi, nhiễm trùng huyết, viêm màng não. Điều này đã nói lên vai trò quan trọng của C3b trong chống nhiễm trùng.
Người ta đã ghi nhận có sự phối hợp giữa thiếu hụt C5, C6, C7 hoặc C8 với nhiễm trùng neisseria lặp đi lặp lại. Đa số bệnh nhân bị nhiễm lậu cầu nhiều lần, nhất là nhiễm trùng huyết và viêm khớp do lậu cầu. Bệnh nhân có thể viêm màng não do màng não cầu.
Thiếu h ụt chất ức chế C1 là thiếu hụt bẩm sinh thường gặp nhất của hệ thống bổ thể và gây ra chứng phù mạch (angioedema) bẩm sinh.
Thiếu hụt miễn dịch thứ phát
Nguyên nhân của thiếu hụt miễn dịch thứ phát
Nguyên nhân gây thiếu hụt miễn dịch thứ phát phổ biến hơn nhiều so với thiếu hụt tiên phát. Bởi vì chức năng hoạt động của các thành phần của hệ miễn dịch phụ thuộc vào sự cân bằng giữa sự tổng hợp và sự thóai hóa chúng nên sự thiếu hụt thứ phát sẽ xảy ra khi sự tổng hợp kém đi hoặc sự thoái hóa tăng lên.
Sự mất protein của c ơ thể có thể dẫn đến giảm gammaglobulin máu. Đó là trường hợp thường gặp của hội chứng thận hư (gây mất protein qua đường thận) và các bệnh lý ruột gây mất protein. Sự mất protein trong bệnh thận thường có tính chọn lọc, do đó ta có thể thấy rằng lượng IgM vẫn bình thường còn IgG thì giả m rõ. Trong bệnh lý ruột, mất protein có thể gặp trong một số bệnh như bệnh Crohn, viêm đại tràng loét và bệnh celiac. Trong bệnh cảnh giãn bạch mạch đường ruột, ta có thể thấy mất cả tế bào lymphô lẫn protein.
Hình ảnh giảm sinh tổng hợp có thể thấy rõ trong suy dinh dưỡng protein – năng lượng. Thiếu hụt protein dẫn đến biến đổi sâu sắc ở các cơ quan trong cơ thể kể cả hệ miễn dịch. Trong trường hợp này chúng ta có thể thấy giảm khả năng sản xuất kháng thể khi cơ thể được gây miễn dịch, đồng thời, miễn dịch tế bào, chức năng thực bào và hoạt tính bổ thể cũng thay đổi. Thiếu hụt miễn dịch do nguyên nhân này có thể hồi phục trong một số trường hợp khi cơ thể được bù đầy đủ protein và calo.
Bệnh nhân bị bệnh tăng sinh lymphô có xu hướng rất dễ nhiễm trùng. Sự xuất hiện thường xuyên của nhiễm trùng cơ hội trên những người bị ung thư lan tỏa đã nói lên tình trạng bị suy giảm miễn dịch khá nặng nề do hậu quả ức chế của bệnh hoặc do điều trị. Bệnh bạch cầu lympho mạn tính thường đi kèm với giảm gammaglobulin máu và nhiễm trùng hô hấp tái phát nhiều lần và điều này đã làm cho bệnh ngày càng nặng dần nhanh chóng. Có trường hợp nếu ta cho bù immunoglobulin thì bệnh sẽ cải thiện. U lympho non-Hodgkin có thể đi kèm với thiếu hụt miễn dịch cả thể dịch lẫn tế bào; lượng Ig vẫn bình thường cho đến giai đoạn muộn của bệnh. Hầu hết các bệnh nhân đa u tủy đều có giảm Ig đa clôn, nhưng lại tăng Ig đơn clôn một cách rất đặc trưng.
Các thuốc ức chế miễn dịch tác động lên rất nhiều khâu của chức năng tế bào. Chức năng của lymphô bào và bạch cầu múi thường giảm. Rất ít khi có giảm gammaglobulin nặng. Bệnh nhân dùng thuốc ức chế miễn dịch trong quá trình điều trị ung thư hoặc bảo vệ mảnh ghép thường rất dễ bị nhiễm trùng cơ hội.
Chúng ta cũng nên lưu ý rằng một số kháng sinh cũng có tác dụng ức chế miễn dịch. Đó là kháng sinh có cấu trúc hóa học giống các thuốc chống chuyển hóa và gây độc tế bào. Ví dụ như gentamicin, amikacin và tobramycin có thể làm giảm khả năng hóa hướng động đối với tế bào trung tính; cotrimoxazole, rifampicin và tetracycline có thể làm biến đổi miễn dịch tế bào; chloramphenicol, cotrimoxazole và rifampicin làm thay đổi đáp ứng kháng thể sơ cấp và thứ cấp.
Trong nhiều bệnh nhiễm trùng, vi sinh vật có khả năng ức chế miễn dịch hơn là kích thích miễn dịch. Người ta đã lưu ý thấy điều này xảy ra nặng nề, mặc dù chỉ thóang qua, trong nhiều bệnh nhiễm trùng virus, nhất là cytomegalovirus, sởi, rubella, đơn nhân nhiễm khuẩn và viêm gan virus và trong một số nhiễm trùng vi khuẩn như lao, brucellosis, phong và giang mai: tuy nhiên, ví dụ rõ nét nhất là bệnh cảnh mới được phát hiện trong những năm gần đây, đó là hội chứng thiếu hụt miễn dịch mắc phải (AIDS).
Hội chứng thiếu hụt miễn dịch mắc phải (AIDS)
Hội chứng thiếu hụt miễn dịch mắc phải (Aquired Immunodeficiency syndrome, AIDS) là một bệnh dịch toàn cầu gây nên do một loại virus mới được phát hiện gần đây có tên là virus thiếu hụt miễn dịch người týp I (Human Immunodeficiency Virus 1, HIV-1). Đây là một virus thuộc họ retrovirus tức những virus RNA có mang một enzym độc đáo là enzym sao chép ngược (reverse transcriptase) có khả năng tổng hợp DNA chuỗi kép đặc trưng cho virus từ genom RNA của mình. DNA mới này sẽ gắn vào genom của tế bào chủ và trở thành khuôn để sản xuất nguyên liệu RNA cho virus con. Virus con hình thành sẽ tạo ch ồi ở màng tế bào chủ và tế bào chủ cũng sẽ cung cấp vật liệu để thành lập vỏ virus.
Retrovirus được chia làm 3 nhóm: (1) oncovirus, bao gồm tất cả các virus sinh ung thư như virus bệnh bạch cầu tế bào T người (Human T cell Leukemia Virus I, HTLV-I); (2) spumavirus, là những virus mà hiện nay chưa thấy gây bệnh gì, và (3) lentivirus, trong đó có HIV-1.
Lentivirus gây những “nhiễm trùng chậm” tức là virus tồn tại một thời gian khá lâu trong cơ thể mới tạo ra các biểu hiện lâm sàng. HIV- 1 là lentivirus gây bệnh ở người được khám phá đầu tiên và cũng là loại đầu tiên tác động lên các lympho bào.
Khỉ và các loại linh trưởng (primates) nuôi trong chuồng là những động vật rất dễ bị mắc bệnh thiếu hụt miễn dịch và người ta đã phân lập được một lentivirus giống HIV từ khỉ maccacus có thể gây hội chứng giống AIDS trên khỉ (người ta gọi là AIDS khỉ). Tại châu Phi, các nhà nghiên cứu cũng đã tìm thấy một virus có họ hàng rất gần với virus AIDS khỉ nói trên và gọi là SIV -1agm; SIV- 1agm hình như không gây bệnh trên con vật sống trong thiên nhiên nhưng có khả năng gây bệnh khi ta tiêm vào khỉ macacus.
Năm 1985, người ta đã tìm thấy kháng thể chống HIV trong huyết thanh những cô gái điếm sống ở vùng Tây Phi, huyết thanh này cho phản ứng vớI SIV -1agm mạnh hơn với HIV. Kết quả là mộ t lentivirus mới được phát hiện và được đặt tên là HIV-2, vì virus này cũng gây hội chứng giống AIDS cho người.
Dịch tễ học AIDS
Trước tiên, một điều thực sự khủng khiếp hiện nay là virus gây bệnh AIDS, tức HIV, đang lan tràn khắp thế giới với tốc độ khá nhanh mà sự ngăn chặn không phải là một việc làm đơn giản. Theo một tài liệu dịch tễ học công bố trên tờ Scientific American năm 1988 tại Hoa Kỳ, Jonathan M. Mann, James Chin, Peter Piot và Thomas Quinn cho biết rằng đến năm 1988 có hơn 250.00 trường hợp mắc bệnh được thống kê trên khắp thế giới, bên cạnh đó, có khoảng từ 5 đến 10 triệu người nhiễm HIV. Năm năm sau tình trạng đã trở nên xấu hơn nhiều. Liên minh chính sách AIDS tòan cầu (Global AIDS Policy Coalition) đã ước tính rằng vào cuối năm 1987 số người nhiễm HIV khoảng 7 triệu, nhưng đến cuối năm 1992 thì đã lên đến khoảng 110.5 triệu, tức tăng khoảng gấp 3 lần. Mặc dù có một số thuốc chống virus cũng như một số phương tiện khác có thể giúp phần nào đời sống, hầu hết người nhiễm đã đi đến tình trạng bi quan là tử vong. Cho đến năm 1993 có khoảng 3 triệu người mắc bệnh ở giai đoạn toàn phát, trong đó đa số đã chết. Các tính toán đã thông báo rằng vào năm 2001 số người nhiễm HIV là hơn 40 triệu.
Sự lan truyền của HIV-1
HIV-1 có thể phân lập từ tinh dịch, chất tiết cổ tử cung, tế bào lympho, huyết tương, dịch não tủy, nước mắt, nước bọt, nước tiểu và sữa mẹ. Nhưng không phải tất cả các dịch này đều có thể truyền bệnh bởi vì nồng độ virus trong chúng rất khác nhau, vì thế chỉ có tinh dịch, máu và có thể cả dịch cổ tử cung đã được chứng minh là có thể truyền bệnh.
Cách truyền phổ biến nhất của virus trên thế giới (Bảng 10.4) là quan hệ tình dục dù đồng giới hay khác giới. Việc lây truyền cũng có thể xảy ra qua đường dùng chung kim tiêm giữa những người tiêm chích do nghiện ngập hoặc những bệnh nhân được điều trị ở bệnh viện không thực hiện đúng qui trình vô trùng. Việc truyền bệnh từ mẹ sang con trong quá trình mang thai hoặc lúc sinh đẻ là đường lây chủ yếu đối với AIDS trẻ em. Ngoài ra chúng ta còn nghe nói đến những trường hợp bị lây bệnh do nhận máu, sản phẩm máu, nhận cơ quan ghép hoặc tinh dịch có HIV.
Bảng 10.4. Đặc diểm của bệnh nhân AIDS ở người lớn
| Tỉ lệ % bệnh nhân | Hoa kỳ | Anh |
| Nam tình dục đồng giới/lưỡng giới | 66 | 87,5 |
| Người nghiện tiêm chích tĩnh mạch | 17 | 1.5 |
| Bệnh nhân mắc bệnh ưa cháy máu | 1 | 4 |
| Người nhận máu có HIV | 2 | 2 |
| Người tình dục khác giới | 4 | 3.5 |
| Các loại khác | 3 | 0.5 |
| Nam | 93 | 96.5 |
| Nữ | 7 | 3.5 |
Ngoài ra, người ta đã ghi nhận có một số ca nhân viên y tế có phản ứng huyết thanh dương tính do kim đâm hoặc dính máu bệnh nhân. Tuy nhiên, đường truyền theo muỗi, rệp, truyền qua hồ bơi, qua dùng chung dụng cụ ăn uống, dụng cụ vệ sinh hoặc thở chung không khí với bệnh nhân thì chưa được chứng minh.
Hình ảnh lâm sàng của nhiễm HIV-1
AIDS không phải là hậu quả độc nhất của nhiễm HIV-1: virus có thể gây ra nhiều bệnh cảnh (Hình 10.7) mà nhìn chung thì tiên lượng đều xấu.
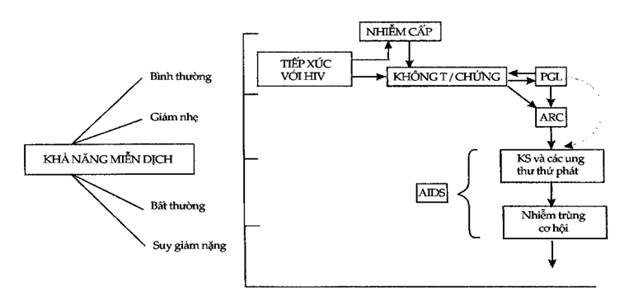
Hình10.7. Các giai đoạn lâm sàng củanhiễm HIV-1
PGL = Bệnh lý hạch toàn thân kéo dài;
ARC = Phức hợp cận AIDS;
KS = U Kaposi
Bệnh cảnh sốt có nổi hạch cấp tính có thể xảy ra thoáng qua trên 10- 20% bệnh nhân trong những tuần lễ đầu tiên sau khi nhiễm HIV-1. Xét nghiệm máu ngoại biên cho thấy có 50% tế bào lymphô không điển hình, đồng thời có gia tăng số lượng tế bào T ức chế vào thời điểm này. Hầu hết những người huyết thanh dương tính rồi sẽ không có triệu chứng gì, ít nhất là trong một thời gian ngắn, và sau đó sự xuất hiện của AIDS có lẽ sẽ phụ thuộc vào các yếu tố kèm theo như cơ địa di truyền, bị kích thích lặp đi, lặp lại của kháng nguyên ngoại lai hoặc mang thai.
Sau một thời gian tiềm tàng kéo dài khoảng từ vài tháng đến 7 năm hay hơn nữa, những người nhiễm HIV-1 sẽ đi vào một quá trình bệnh lý gọi là bệnh lý hạch toàn thân kéo dài (persistent generalized lymphadenopathy, PGL). Các nghiên cứu trên những bệnh nhân đồng tính luyến ái nam bị PGL cho thấy rằng có khoảng 10-25% những người này sẽ tiến triển qua AIDS trong vòng 3 năm.
Một số người huyết thanh dương tính có thể có các biểu hiện khác như sưng hạch, ỉa chảy, ra mồ hôi đêm, nhiễm candida miệng và sụt cân mà không giải thích được nguyên nhân. Người ta gọi phức hợp cận AIDS đối với những trường hợp có ít nhất hai triệu chứng lâm sàng và hai hoặc nhiều hơn các dấu hiệu cận lâm sàng liệt kê ở Bảng 3.5.
HIV cũng là một virus hướng thần kinh; do đó người ta đã thông báo gặp những bệnh cảnh thần kinh như viêm màng não vô trùng cấp, bệnh lý não, bệnh lý tủy sống và bệnh thần kinh ngoại biên trên người bị nhiễm HIV vào giai đoạn sớm. Ngoài ra, vào giai đoạn muộn còn có thể thấy viêm màng não mạn tính, bệnh lý não mạn tính và trì trệ tinh thần.
Các biểu hiện lâm sàng chính của AIDS là ung thư và nhiễm trùng cơ hội. Hiện nay, chẩn đoán AIDS được thiết lập đối với những người có: (1) bệnh lý thể hiện rõ nét thiếu hụt miễn dịch tế bào ở mức độ vừa và nặng như viêm phổi do pneumocystis carinii hoặc u Kaposi; và (2) không tìm thấy các nguyên nhân khác của sự thiếu hụt miễn dịch tế bào cũng như nguyên nhân của giảm sức đề kháng đối với nhiễm trùng.
Bảng 10.5. Chẩn đoán phức hợp cận AIDS
| Hai triệu chứng lâm sàng | + Hai bất thường về xét nghiệm |
| Sốt và/hoặc ra mồ hôi đêm (>3 tháng)
Mệt người Sút cân (>10% trọng lượng cơ thể) Sưng hạch (>3 tháng) Ỉa chảy không rõ nguyên nhân |
Giảm lymphô bào
Giảm tiểu cầu Giảm tế bào T giúp đỡ Tăng gammaglobulin máu Giảm khả năng chuyển dạng lymphô bào Dị ứng da với các kháng nguyên gặp lại |
Chẩn đoán bị loại bỏ nếu tất cả các xét nghiệm cận lâm sàng nói lên tình trạng thiếu hụt miễn dịch đều âm tính.
U kaposi là loại u thường được đề cập nhất, nhưng các loại u khác cũng càng ngày càng được mô tả nhiều hơn như: u lymphô non-Hodgkin, u tế bào vảy ở miệng và trực tràng hậu môn.
Nhiễm trùng cơ hội trong AIDS có thể xảy ra ở bất cứ cơ quan nào nhưng cơ quan thường bị nhất là phổi, ống tiêu hóa và hệ thần kinh trung ương. Ngoài nhiễm trùng cơ hội, các cơ quan này còn có thể bị thâm nhiễm bởi u hoặc bị tác động trực tiếp của HIV-1 mà hệ thần kinh trung ương là một ví dụ điển hình.
Trẻ bị AIDS do mẹ truyền sang thường phát bệnh vào tuổi trung bình khoảng 6 tháng, trong khi đó trẻ sơ sinh nhiễm bệnh do truyền máu thì phát bệnh sau khoảng 12-15 tháng. Cả hai nhóm đều có bệnh cảnh lâm sàng giống nhau: trẻ không phát triển và hầu như tất cả đều có nhiễm candida ở miệng cũng như nhiễm trùng sinh mủ lặp đi lặp lại. Viêm phổi kẽ mãn tính là bệnh cảnh rất đặc trưng. Vào giai đoạn muộn, nhiễm trùng cơ hội điển hình có thể xuất hiện những u Kaposi và các ung thư khác thì hiếm khi gặp ở các trẻ này.
Tiên lượng đối với AIDS thật buồn thảm: nói chung là sẽ chết, và thời gian sống sót tùy thuộc vào biểu hiện lâm sàng. Thời gian sống còn đối với người bị nhiễm phổi do pneumocystis carinii là 9-12 tháng, đối với các nhiễm trùng cơ hội khác là 6-12 tháng và đối với u Kaposi là 20-30 tháng.
Miễn dịch học của AIDS
HIV-1 chui vào các tế bào thích hợp nhờ gắn glycoprotein của mình vào một receptor trên bề mặt tế bào, đó là phân tử CD4. Những tế bào có mang kháng nguyên CD4 đều có khả năng nhiễm HIV-1: điển hình là tế bào lymphô T giúp đỡ, một số tế bào B, đại thực bào, tế bào thần kinh đệm, và ngoài ra một số tế bào biểu mô của đại – trực tràng cũng mang CD4 với mật độ thấp.
Những bệnh phối hợp HIV (HIV-associated diseases) được đặc trưng bởi những tổn thương của chức năng miễn dịch (Bảng 10.6). Những tổn thương này xảy ra do sự suy giảm số lượng tế bào CD4+, nhất là tế bào T giúp đỡ. Khi tế bào T giúp đỡ bình thường được kích thích bởi kháng nguyên chúng đáp ứng bằng cách phân bào và giải phóng các lymphokin, bao gồm interleukin-2, interferon và yếu tố phát triển tế bào B (B cell growth factor, BCGF): những chất này điều hòa sự phát triển, trưởng thành và hoạt hóa các tế bào lympho khác, các tế bào mono cà đại thực bào.
Tế bào T gây độc sau khi được hoạt hóa sẽ tiêu diệt các tế bào bị nhiễm virus, trong khi đó đại thực bào hoạt hóa tiêu hủy các vi khuẩn nội bào như Mycobacterium tuberculosis. Còn interferon, một lymphokin khác thì kích thích sự tiêu hóa của tế bào giết tự nhiên (NK cell) và đồng thời tham gia kiểm soát sự hình thành ung thư.
Như vậy, tác động nổi bật nhất của HIV là nhằm đến đáp ứng qua trung gian tế bào T. Các thử nghiệm invitro có thể cho thấy đáp ứng tăng sinh đối với kháng nguyên lặp lại bị biến đổi do giảm sản xuất IL- 2 ngay cả trên bệnh nhân nhiễm HIV-1 chưa có triệu chứng. Trong quá trình diễn tiến bệnh, bên cạnh sự xuất hiện các triệu chứng mới là sự suy giảm số lượng tuyệt đối của tế bào CD4+, nhất là tế bào T giúp đỡ. Bởi vì trong các nhiễm trùng virus khác có thể có tăng số lượng tế bào CD8+ (chủ yếu là tế bào ức chế và gây độc) trong vòng hai tuần sau khi nhiễm, nhưng ở đây khi bệnh nhân chưa có triệu chứng thì số lượng tế bào lymphô và các tiểu quần thể của chúng vẫn còn bình thường.
Bảng 10.6. Các bất thường miễn dịch chủ yếu trong AIDS
| Các bất thường đặc trưng
Giảm số lượng tuyệt đối tế bào lymphô CD4+ Giảm đáp ứng tăng sinh đối với kháng nguyên hòa tan Thay đổi phản ứng quá mẫn muộn ở da Giảm sản xuất interferon khi đáp ứng với kháng nguyên Hoạt hóa tế bào B đa clôn cùng với tăng sản xuất Ig ngẫu nhiên Giảm đáp ứng dịch thể khi gây miễn dịch Các bất thường khác Giảm lymphô bào Giảm đáp ứng tăng sinh in vitro đối với mitogen tế bào T và kháng nguyên cùng loài Giảm đáp ứng tăng sinh đối với mitogen tế bào B đặc hiệu Giảm sản xuất interleukin-2 Giảm tính gây độ c tế bào với tế bào nhiễm virus Tăng lượng phức hợp miễn dịch Giảm hoạt tính tế bào NK Giảm hóa hướng động monocyte |
Khi bệnh nhân tiến triển đến giai đoạn phức hợp cận AIDS thì các xét nghiệm về chức năng tế bào T in vitro như đáp ứng với mitogen và sản xuất lymphokin bị giảm sút và bệnh nhân mất phản ứng với các thử nghiệm da quá mẫn muộn. Các chức năng của tế bào mono/đại thực bào ngày càng trở nên bất thường và hoạt tính của tế bào NK cũng bị giảm sút. Sinh thiết hạch bạch huyết cho thấy hình ảnh những nang lớn trong đó có thâm nhiễm tế bào lymphô CD8+, giảm tế bào CD4+ và phá hủy cấu trúc lưới bình thường.
Giải thích đơn giản nhất về nguyên nhân của những thay đổi này là tình trạng thi ếu hụt miễn dịch gây ra do tác dụng phá hủy của HIV trên tế bào T giúp đỡ, tế bào mono và đại thực bào. Tình trạng giảm sản xuất lymphokin và giảm hoạt hóa đại thực bào là do nhiễm trùng virus, nấm và vi khuẩn nội bào tồn tại lâu dài. Bệnh nhân đ ôi khi có biểu hiện giảm tế bào trung tính hoặc giảm tiểu cầu; mà bệnh sinh có thể liên quan đến phức hợp miễn dịch.
Sau khi nhiễm HIV một thời gian ngắn, đáp ứng tạo kháng thể vẫn chưa thay đổi, do đó mà kháng thể chống protein vỏ và lõi virus là bằng chứng chính để chẩn đoán nhiễm virus. Về sau, sự hoạt hóa đa clôn đối với tế bào B được phản ánh qua sự gia tăng nồng độ Ig ở 80-90% bệnh nhân AIDS. Nguyên nhân của điều này chưa được hiểu rõ nhưng có lẽ là liên quan trực tiếp đến sự hoạt hóa tế bào B của HIV-1, và có thể trong phối hợp với virus Epstein- Barr. Tuy nhiên, đáp ứng đối với những kháng nguyên mới bị giảm sút, và ngay cả trong những bệnh nhân bị nhiễm trùng cơ hội lan rộng có thể không có tí kháng thể nào xuất hiện làm cho việc chuẩn đoán huyết thanh học kinh điển không thể tin cậy được trên bệnh nhân AIDS.
Phát hiện nhiễm HIV
Kháng thể chống HIV thường xuất hiện khoảng 3 tuần đến 3 tháng sau khi bị nhiễm và sau đó thì tồn tại mãi hầu như suốt đời. Đây là kháng thể chống các glycoprotein vỏ điển hình (gp120 và gp41). Mặc dù kháng thể trung hòa có thể định lượng được nhưng nồng độ thấp và không có ý nghĩa gì trong thời điểm hiện nay. Cũng như trong các nhiễm trùng virus khác, kháng thể chống HIV là bằng chứng trực tiếp của nhiễm trùng đã mắc. Tuy nhiên, không có kháng thể không có nghĩa là không có sự hiện diện của virus.Trên một số bệnh nhân người ta thấy vắng mặt các kháng thể đặc hiệu. Trong số này kể cả những người chỉ mới nhiễm virus được có vài tuần nên sự sản xuất kháng thể chưa đủ để có thể phát hiện được; và những người ở giai đoạn cuối của AIDS, lúc đó mức kháng thể giảm sút nhiều hoặc biến mất.
Kháng nguyên virus, nhất là kháng nguyên lõi của HIV- 1 (gp41) cũng có mặt trong huyết thanh nhưng chỉ phát hiện được vào giai đoạn có thừa kháng thể đối với p24, điều này xảy ra vào lúc ban đầu của nhiễm trùng và trước khi bệnh tiến triển sang phức hợp cận AIDS hoặc AIDS.
Các hướng điều trị AIDS
Những kiến thức về đường xâm nhập của HIV vào tế bào CD4+ và cách th ức nhân lên của chúng đã giúp chúng ta tìm ra các biện pháp điều trị có hứa hẹn (Hình 10.8)
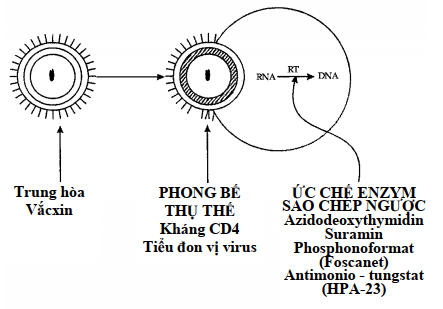
Hình 10.9. Các phương pháp đ iều trị nhằm ngăn ngừa hoặc loại trừ nhiễm HIV-1. (RT = enzym sao chép ngược)
Sự gắn của virus vào phân tử CD4 trên bề mặt tế bào có thể ức chế được nhờ kháng thể chống vỏ virus hay chống receptor. Trong việc phòng bệnh, kháng thể chống virus phải là kháng thể trung hòa, và mục tiêu của vắc-xin thích hợp là tạo ra một kháng thể như vậy.
Các vacxin cổ điển dùng virus chết hoặc giảm độc lực hình như không có giá trị trong trường hợp AIDS. Tính chất mong manh của vỏ HIV làm cho nó có tính sinh miễn dịch kém. Đồng thời khả năng biến đổi kháng nguyên của retrovirus rất nguy hiểm trong trường hợp của HIV, nhất là khi cũng đột biến để trở lại dạng hoạt động. Do đó, vacxin HIV không được có những đoạn RNA có khả năng nhân lên. Việc dùng kỹ thuật DNA tái tổ hợp đã tạo ra được nhiều sản phẩm có thể dùng để sản xuất vắc xin, nhưng tất cả đều trong giai đoạn thí nghiệm.
Ức chế nhân lên của virus có thể thực hiện được bằng cách ức chế hoạt tính của enzym sao chép ngược (reverse transcriptase) là enzym retrovirus duy nhất không có ở thú vật. Có nhiều thu ốc ức chế được enzym sao chép ngược trong phòng thí nghiệm nhưng trong cơ thể thì tác dụng rất kém hoặc không tác dụng. Azidothymidin (AZT) là thuốc đang thông dụng trên thị trường có tác dụng ức chế sự nhân lên của virus. Nó là chất đồng dạng của thymidin lấy được từ DNA tiền virus. Tuy nhiên, AZT không thể chữa khỏi AIDS vì nó không diệt tận g ốc được genom của virus. Ngoài ra, tác dụng độc của nó đối với tủy xương đã làm hạn chế việc dùng thuốc lâu dài nhất là ở những cá thể chưa có triệu chứng.
Một biện pháp khác quan trọng không kém sự phòng ngừa nhân lên của virus là xây dựng lại hệ thống miễn dịch của cơ thể chủ. Người ta đã thử dùng IL-2, interferon hoặc ghép t ủy nhưng chưa thấy thành công nào rõ rệt. Trong điều trị nên phối hợp việc xây dựng lại hệ thống miễn dịch với liệu pháp chống virus.
Nhiễm trùng trên cơ thể suy giảm miễn dịch
Những người bị suy giảm miễn dịch tự nhiên hoặc do dùng thuốc thường rất dễ nhiễm trùng. Những bệnh nhân này có thể bị nguy cơ từ hai nguồn: các tác nhân nhiễm trùng thường gặp (thường gây bệnh cho cả người lành và bệnh nhân) và các nhiễm trùng “cơ hội” (tức là các vi sinh vật thường không có khả năng gây bệnh nhưng khi cơ thể bị suy yếu về mặt miễn dịch thì chúng nhân cơ hội đó dễ gây bệnh).
Chúng ta phải luôn lưu ý đến những nhiễm trùng cơ hội do thuốc gây ra. Theo một khảo sát trên 75 bệnh nhân bị mắc các bệnh “miễn dịch” (như bệnh chống màng đáy cầu thận, lupus ban đỏ hệ thống…) được điều trị bằng các thuốc ức chế miễn dịch thì tỉ lệ nhiễm trùng là 3,7 lần/người; hoặc 0,74 lần/người/tuần có suy giảm miễn dịch. Vào khoảng 2/3 số biến chứng nhiễm trùng gây ra bởi các vi khuẩn “thông thường” tức là các mầm bệnh đối với người bình thường. Các tác nhân cơ hội chiếm 1/3, trong đó có một số nhiễm trùng cơ hội rất nặng (chiếm 11% toàn bộ các nhiễm trùng biến chứng). Trong số 10 bệnh nhân chết do nhiễm trùng trong nhóm bệnh nhân này, có đến 8 người chết do nhiễm trùng cơ hội: một điều đáng lưu ý là ½ số vi sinh vật gây chết người chỉ tìm thấy khi mổ tử thi.
Nhiều nghiên cứu đã tổng kết để đưa ra các mô hình nhiễm trùng có thể dùng trong chẩn đoán đối với các cơ thể chủ lực bị ức chế miễn dịch (Hình 10.9).
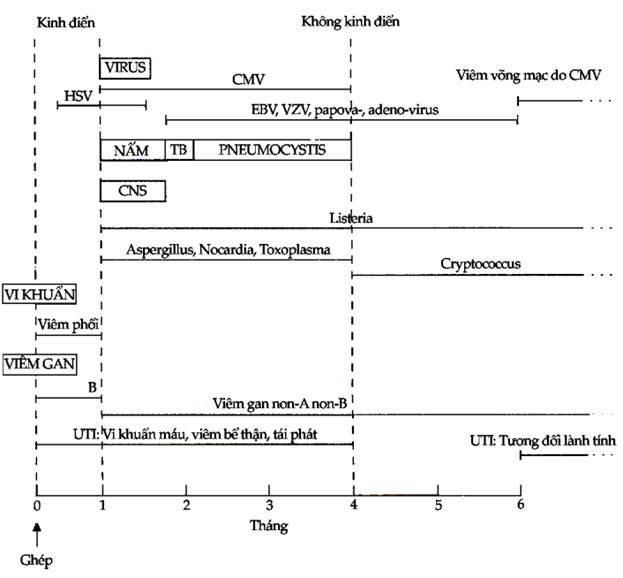
Hình 10.9. “Lịch” xuất hiện của nhiễm trùng trên bệnh nhân ghép thận
HSV = Virus Herpes Zoster; CMV = Virus Cytomegalovirus; EBV = Virus Epstein-Barr; VZV = Virus Varicella Zoster; UTI = Nhiễm trùng đường tiểu
Những bệnh nhân được nghiên cứu kỹ nhất là bệnh nhân ghép thận. Vào tháng đầu sau khi ức chế miễn dịch, các nhiễm trùng cơ hội hầu như không có. Thay vào đó nguyên nhân nhiễm trùng chính là nhiễm trùng do vết thương phẫu thuật, do các ống xông hoặc nhiễm trùng phổi sau phẫu thuật. Giữa tháng thứ nhất và tháng thứ tư sau khi ức chế miễn dịch, nhiễm trùng cytomegalovirus chiếm ưu thế trong bối cảnh có thể có nhiều nhiễm trùng khác như nhiễm nấm, virus và đơn bào: đây là giai đoạn nhiễm trùng nguy hiểm nhất. Nhiễm trùng từ tháng thứ tư trở đi có thể xếp thành 3 nhóm: nhóm 1 là nhiễm virus mạn tính, đặc biệt là CMV; nhóm 2 là nhiễm trùng cơ hội thỉnh thoảng, mà đáng chú ý nhất là nhiễm Pneumocystis carinii. Cryptococcus neoformans và Listeria monocytogenes; và nhóm 3 là các nhiễm trùng thường gặp trong cộng đồng.
Trong cơ thể có hai cổng vào chính đối với các vi sinh vật cơ hội: vùng mũi họng hầu và phần dưới ống tiêu hóa. Hít các vi khuẩn đang sống trong vùng mũi họng hầu vào phổi là cơ chế thường gặp dẫn đến viêm phổi, còn sự lan tỏa vi khuẩn từ đường tiêu hóa thì thường gây nhiễm trùng huyết. Phổi là nơi nhiễm trùng phổ biến nhất. Hình ảnh lâm sàng không đặc hiệu: sốt, khó thở và ho khan trên một bệnh nhân có thâm nhiễm phổi lan tỏa trên phim X-quang. Cấy đờm và cấy máu thường không giúp tìm ra vi sinh vật gây bệnh. Cần phải dùng những phương pháp phức tạp hơn như rửa phế quản – phế nang hay sinh thiết phế quản mới mong chẩn đoán được nguyên nhân. Sau khi đã loại trừ các vi khuẩn gây bệnh thường gặp nhất là CMV, aspergillus, candida hoặc pneumocystis carinii. Chúng ta cần nhận rõ tầm quan trọng của chẩn đoán và điều trị sớm (nếu được) khi thấy rằng những nhiễm trùng phổi như vậy thường mang lại hậu quả rất xấu cho bệnh nhân suy giảm miễn dịch: tỉ lệ tử vong chung là 50-65%.
Thiếu hụt miễn dịch
- Tác giả: Đại học Y Hà Nội
- Chuyên ngành: Miễn dịch – Di truyền – Sinh học phân tử
- Nhà xuất bản:Đại học Y Hà Nội
- Năm xuất bản:2006
- Trạng thái:Chờ xét duyệt
- Quyền truy cập: Cộng đồng